题目内容
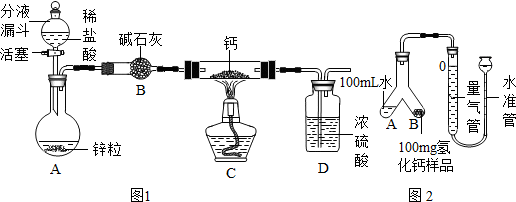
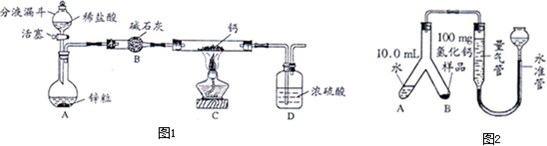
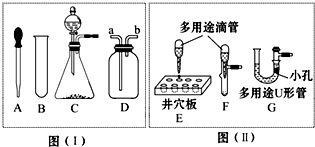 图(Ⅰ)是部分常用化学仪器或装置,图(Ⅱ)是部分“微型”化学仪器或装置(用“微型”仪器做实验,其试剂用量和废物排放量是通常用量的1/10或更少,符合绿色化学的理念).对比图(Ⅰ)、图(Ⅱ)回答以下问题:
图(Ⅰ)是部分常用化学仪器或装置,图(Ⅱ)是部分“微型”化学仪器或装置(用“微型”仪器做实验,其试剂用量和废物排放量是通常用量的1/10或更少,符合绿色化学的理念).对比图(Ⅰ)、图(Ⅱ)回答以下问题:
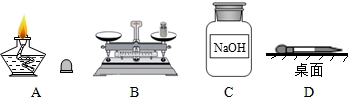
(1)图(Ⅰ)中A、B的名称分别是______、______;若在D装置中盛满水,用排水法收集一瓶氧气,气体应从______端(填“a”或“b”)通入.
(2)用图(Ⅱ)中的“微型”仪器做实验,固体只需极少量、液体用量也很少(或只需1~2小滴),相对用图(Ⅰ)仪器做实验的优点是______(填序号).
①节约药品用量 ②能完全消除实验污染 ③若需加热也能节约燃料
(3)图(Ⅰ)中的C装置的作用相当于图(Ⅱ)中的装置______(填字母),它们在实验操作上的共同优点是通过控制______来控制反应速度.
(4)图(Ⅰ)中的C装置和图(Ⅱ)中的G即“多用途U形管”(是在U形管中套入一个底部有小孔的具支试管)都可用做“固-液”反应制取气体.若在反应进行中分别将两装置的橡胶管中部夹上铁夹,可能出现的现象是:C装置______;G装置______.
解:(1)图(I)中A为胶头滴管,B为试管;氧气的密度比水小,因此用排水法收集一瓶氧气,气体应从b端通入;
(2)图(II)中所给的仪器为微型仪器,可以节约药品而不影响实验现象,可以较方便的来操作完成实验,同时由于所取的量少,即使加热所需的燃料也少,但是不能够完全消除实验污染,故选①③;
(3)根据装置的特点可以知道:图(I)中C装置通过分液漏斗添加液体药品,当需要气体时,打开活塞,不需要气体时,关闭活塞,从而能够控制反应的发生和停止;而图(II)中的F装置通过胶头滴管添加液体药品,当需要气体时,挤压胶头,不需要气体时,停止挤压,从而能够控制反应的发生和停止,即图(I)中的C装置和图(II)中的F装置具有相同的作用.
(4)C装置:夹上铁夹后,装置内产生的气体排不出去,气体压强增大,可能导致橡胶塞冲出;多用途U型管:夹上铁夹后,具支试管内产生的气体排不出去,具支试管内的气体压强增大,把试管内的液体压出去,从而U型管两侧的液面上升,反应停止.
故答案为:(1)胶头滴管;试管;b;(2)①③;(3)F;液体加入量;(4)橡胶塞冲出;液体和固体分离,反应停止.
分析:(1)直接写出仪器的名称以及氧气的密度比水小进行解答;
(2)从操作是否简便、是否节约药品、是否节能环保、是否方便使用等角度分析;
(3)根据装置的特点来分析判断并作出解答;
(4)根据大气压强的知识进行分析.
点评:本题包含了丰富的实验基本技能知识,要求学生熟悉实验仪器,同时对实验原理有较深刻的认识和理解.
(2)图(II)中所给的仪器为微型仪器,可以节约药品而不影响实验现象,可以较方便的来操作完成实验,同时由于所取的量少,即使加热所需的燃料也少,但是不能够完全消除实验污染,故选①③;
(3)根据装置的特点可以知道:图(I)中C装置通过分液漏斗添加液体药品,当需要气体时,打开活塞,不需要气体时,关闭活塞,从而能够控制反应的发生和停止;而图(II)中的F装置通过胶头滴管添加液体药品,当需要气体时,挤压胶头,不需要气体时,停止挤压,从而能够控制反应的发生和停止,即图(I)中的C装置和图(II)中的F装置具有相同的作用.
(4)C装置:夹上铁夹后,装置内产生的气体排不出去,气体压强增大,可能导致橡胶塞冲出;多用途U型管:夹上铁夹后,具支试管内产生的气体排不出去,具支试管内的气体压强增大,把试管内的液体压出去,从而U型管两侧的液面上升,反应停止.
故答案为:(1)胶头滴管;试管;b;(2)①③;(3)F;液体加入量;(4)橡胶塞冲出;液体和固体分离,反应停止.
分析:(1)直接写出仪器的名称以及氧气的密度比水小进行解答;
(2)从操作是否简便、是否节约药品、是否节能环保、是否方便使用等角度分析;
(3)根据装置的特点来分析判断并作出解答;
(4)根据大气压强的知识进行分析.
点评:本题包含了丰富的实验基本技能知识,要求学生熟悉实验仪器,同时对实验原理有较深刻的认识和理解.

练习册系列答案
相关题目