题目内容
【题目】工业上常用赤铁矿(主要成分是Fe2O3)、磁铁矿(主要成分是Fe3O4)炼铁。计算:
①Fe2O3的相对分子质量是多少;
②Fe3O4中铁元素和氧元素的质量比是多少;
③通过计算说明,Fe3O4和Fe2O3哪种铁的氧化物含铁量更高?
【答案】①160;② 7∶3 ;③Fe3O4
【解析】①Fe2O3的相对分子质量是∶56×2+16×3=160;②Fe3O4中铁元素和氧元素的质量比是56×2∶16×3=7∶3 ;③Fe3O4和Fe2O3氧化物中铁元素质量分数∶![]() ×100%=72.4%,
×100%=72.4%,![]() ×100%=70%。Fe3O4比Fe2O3含铁量更高。
×100%=70%。Fe3O4比Fe2O3含铁量更高。
答∶①Fe2O3的相对分子质量是160;②Fe3O4中铁元素和氧元素的质量比是7∶3 ;
③Fe3O4比Fe2O3含铁量更高。

练习册系列答案
相关题目
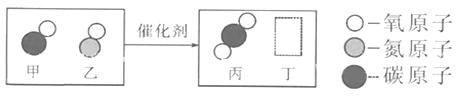
【题目】物质都是由微观粒子构成的。在构成下列四种物质的微粒示意图中, “○”和“![]() ”分别表示氢和氧两种元素的原子。
”分别表示氢和氧两种元素的原子。
物 质 | 甲 | 乙 | 丙 | 丁 |
构成该物质的粒子 |
|
|
|
|
(1)乙物质的一个分子中含有_______________个原子。
(2)四种物质中,属于单质的是 _____________(填物质代号,下同)。
(3)四种物质中,不同种元素原子个数比为1:1的是_______,含有H2分子的是 _________ 。
(4)甲物质在一定条件下反应可生成丙,该反应的符号表达式为________________________,该反应属于_______________反应(填“化合”或“分解”)。