题目内容
 某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.实验准备:
某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.实验准备:(1)用98%的浓硫酸配制l0%的硫酸溶液.现有烧杯、玻璃棒、量筒,还需要的仪器有
胶头滴管
胶头滴管
;[方案一]在等质量的镁条和铝片的两支试管中,分别与相同体积相同质量分数的硫酸反应,观察到镁比铝反应更剧烈,说明
镁比铝的金属活动性强
镁比铝的金属活动性强
.[反思]:有的同学认为这种方案不够合理,理由是
金属与酸的接触面积不同,与酸的反应速度也不同
金属与酸的接触面积不同,与酸的反应速度也不同
.[方案二]
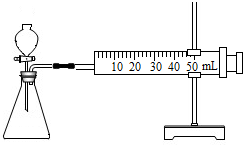
(1)连接仪器组装成如右图所示实验装置.某学生用抽拉法检查该装置的气密性,发现被拉出的针筒活塞一段时间后又回到原来的位置,你认为该装置是否漏气?
不漏气
不漏气
.(2)依次进行镁、铝与硫酸反应,写出镁与硫酸反应的化学方程式:
Mg+H2S04═MgS04十H2↑
Mg+H2S04═MgS04十H2↑
;要比较两种金属活动性强弱,可以测定两种金属硫酸反应得到相同体积氢气所需要的时间;还可测定相同时间内产生的气体体积
相同时间内产生的气体体积
.[拓展]镁与铝分别与足量的质量分数为l0%稀硫酸反应,如制得相同质量的氢气,则镁与铝的质量比为
4:3
4:3
.[方案三]请设计一个与上述实验不同的方案,比较镁和铝的金属活动性强弱:
将镁条、铝条分别在空气中点燃,比较现象
将镁条、铝条分别在空气中点燃,比较现象
.分析:【实验准备】(1)根据配制溶液操作分析用到的仪器,并根据稀释浓硫酸的要求及注意事项分析;
【方案一】根据金属与酸反应的剧烈程度比较金属的活动性;
【反思】根据影响反应速率的因素分析解答;
【方案二】(1)根据检查装置气密性的原理分析;
(2)根据镁与硫酸的反应原理写出方程式;比较两种金属活动性强弱,可以测定两种金属硫酸反应得到相同体积氢气所需要的时间;还可测定等时间内产生气体的体积;
【拓展】根据镁与酸反应时化合价为+2价、铝与酸反应时的化合价为+3价,利用一定量金属完全反应产生氢气质量=
×金属质量,可以较简单地计算出产生相同质量氢气时,消耗掉镁和铝的质量比;
【方案三】根据镁铝与氧气的反应设计实验.
【方案一】根据金属与酸反应的剧烈程度比较金属的活动性;
【反思】根据影响反应速率的因素分析解答;
【方案二】(1)根据检查装置气密性的原理分析;
(2)根据镁与硫酸的反应原理写出方程式;比较两种金属活动性强弱,可以测定两种金属硫酸反应得到相同体积氢气所需要的时间;还可测定等时间内产生气体的体积;
【拓展】根据镁与酸反应时化合价为+2价、铝与酸反应时的化合价为+3价,利用一定量金属完全反应产生氢气质量=
| 金属元素化合价 |
| 金属相对原子质量 |
【方案三】根据镁铝与氧气的反应设计实验.
解答:解:【实验准备】(1)用98%的浓硫酸配制l0%的硫酸溶液.除了需要上述仪器外,还 需要用到量筒量取浓硫酸以及水的体积,接近刻度线时用胶头滴管;在稀释浓硫酸时,一定要把浓硫酸慢慢注入水中,并不断搅拌;
【方案一】由于两种金属与硫酸反应时镁比铝反应更剧烈,说明镁比铝的活动性强;
【反思】由于用的是镁条和铝片,金属与酸的接触面积不同,也能影响金属与酸反应的速率;所以没控制相同的条件,金属表面产生气泡的快慢,也会受到影响;
【方案二】(1)如果装置不漏气,针筒的活塞被拉出一段后,针筒内压强变小,在大气压的作用下,活塞一段时间后又回到原来的位置;
(2)镁与硫酸反应生成了硫酸镁和氢气,反应的化学方程式是:Mg+H2S04═MgS04十H2↑;要比较两种金属活动性强弱,可以测定两种金属与硫酸反应得到相同体积氢气所需要的时间;还可测定相同时间内产生的气体体积;
【拓展】假设消耗镁的质量为M,消耗铝的质量为A,
×M=
×A 解得 M:A=4:3;
【方案三】由于镁、铝的活泼性不同,在空中与氧气的反应不同.所以,比较镁和铝的金属活动性强弱,还可设计实验:将镁条、铝条分别在空气中点燃,比较现象的不同进行分析;
故答案为:【实验准备】(1)胶头滴管;
【方案一】镁比铝的金属活动性强;
【反思】金属与酸的接触面积不同,与酸的反应速度也不同;
【方案二】(1)不漏气;
(2)Mg+H2S04═MgS04十H2↑;相同时间内产生的气体体积;
【拓展】4:3;
【方案三】将镁条、铝条分别在空气中点燃,比较现象;
【方案一】由于两种金属与硫酸反应时镁比铝反应更剧烈,说明镁比铝的活动性强;
【反思】由于用的是镁条和铝片,金属与酸的接触面积不同,也能影响金属与酸反应的速率;所以没控制相同的条件,金属表面产生气泡的快慢,也会受到影响;
【方案二】(1)如果装置不漏气,针筒的活塞被拉出一段后,针筒内压强变小,在大气压的作用下,活塞一段时间后又回到原来的位置;
(2)镁与硫酸反应生成了硫酸镁和氢气,反应的化学方程式是:Mg+H2S04═MgS04十H2↑;要比较两种金属活动性强弱,可以测定两种金属与硫酸反应得到相同体积氢气所需要的时间;还可测定相同时间内产生的气体体积;
【拓展】假设消耗镁的质量为M,消耗铝的质量为A,
| 2 |
| 24 |
| 3 |
| 27 |
【方案三】由于镁、铝的活泼性不同,在空中与氧气的反应不同.所以,比较镁和铝的金属活动性强弱,还可设计实验:将镁条、铝条分别在空气中点燃,比较现象的不同进行分析;
故答案为:【实验准备】(1)胶头滴管;
【方案一】镁比铝的金属活动性强;
【反思】金属与酸的接触面积不同,与酸的反应速度也不同;
【方案二】(1)不漏气;
(2)Mg+H2S04═MgS04十H2↑;相同时间内产生的气体体积;
【拓展】4:3;
【方案三】将镁条、铝条分别在空气中点燃,比较现象;
点评:本题是一道综合知识题目,考查的角度较广,难度较大,既考查了对金属活动性顺序的掌握和应用,又考查了金属与酸反应时的质量计算,要求同学们要根据题意认真分析解答.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
 (2012?南通)某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.
(2012?南通)某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.

