题目内容
【题目】天然水净化为自来水的主要流程如下:
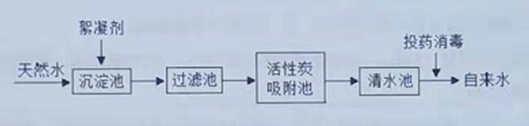
(1)天然水中含有的部分杂质如下表所示,请根据表中内容回答问题。
溶解物质 | 悬浮物质 | |
主要气体 | 主要离子 | 细菌、藻类、 泥沙、黏土 |
氧气(O2)、二氧化碳(CO2)硫化氢(H2S) | 钙离子、 氯离子、硫酸根、铝离子 | |
①上表“主要气体”中含有氧分子的有____________。
②写出“主要离子”中任意一种离子的符号________________。
(2)下列说法错误的是________(填序号)
A 过滤池可以除去难溶性杂质
B 活性炭吸附池可以除去水中的色素和臭味
C 清水池中一定是软水
D 投药消毒环节发生了化学变化
(3)常用的鉴别硬水和软水的方法是往水样中加入____________。
(4)电解水实验揭示了水的组成,装置如图所示。
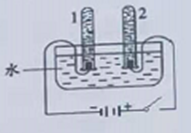
①闭合开关后,收集到氧气的试管是___________(填“1”或“2”),反应的化学方程式为_______。
②该实验得出的关于水的组成的结论是__________。
【答案】氧气 Ca2+(或Cl-或SO42-或Al3+) C 肥皂水 2 2H2O ![]() 2H2↑+ O2 ↑ 水是由氢元素和氧元素组成
2H2↑+ O2 ↑ 水是由氢元素和氧元素组成
【解析】
(1)①大量的氧分子聚集成氧气,上表“主要气体”中含有氧分子的是氧气;
②离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。钙离子带2个单位的正电荷的阳离子,其离子符号表示为Ca2+;氯离子带1个单位的负电荷的阴离子,其离子符号表示为Cl-;硫酸根离子的符号为SO42-;铝离子带3个单位的正电荷的阳离子,其离子符号表示为Al3+;
(2)A 过滤能将固体与液体分离,过滤池可以除去难溶性的杂质,故A正确;
B 活性炭具有吸附性,活性炭吸附池可以除去水中的色素和臭味,故B正确;
C 清水池中存在可溶性的杂质,不一定是软水,故C错误;
D 投药消毒环节能杀死水中的微生物,发生了化学变化,故D正确。故选C;
(3)水样加入肥皂水搅拌,泡沫多的软水,泡沫少的是硬水。常用的鉴别硬水和软水的方法是往水样中加入肥皂水;
(4)①水通电时,正极产生氧气,负极产生氢气,体积比为2:1。闭合开关后,收集到氧气的试管是2,反应的化学方程式为2H2O ![]() 2H2↑+ O2 ↑;
2H2↑+ O2 ↑;
②水通电时,正极产生氧气,负极产生氢气,氢气是由氢元素组成,氧气是由氧元素组成,在化学反应中,元素的种类不变,该实验得出的关于水的组成的结论是水是由氢元素和氧元素组成。

 综合自测系列答案
综合自测系列答案【题目】兴趣小组同学为了测定某中碳酸钙的质量分数,称取25.0g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 | 第1次 | 第2次 | 第3次 | 第4次 |
剩余固体质量(g) | 21.6 | 19.2 | 16.2 | 16.2 |
试计算:
(1)完全反应后生成二氧化碳的质量是__g。
(2)求珍珠粉中碳酸钙的质量分数。(写出计算过程)__________.