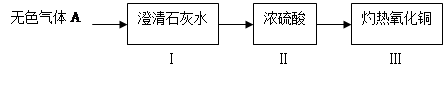
题目内容
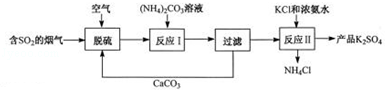
某热电厂用脱硫得到的石膏(CaSO4?2H2O)生产K2SO4肥料的流程如下.
请回答下列问题:
(1)石膏中S的化合价是 .脱硫过程的化学方程式为2CaCO3+2SO2+O2+4H2O=2CaSO4?2H2O+2 .
(2)石膏与饱和(NH4)2CO3溶液相混合,发生反应Ⅰ时需不断搅拌,其目的是 .
(3)实验室完成过滤操作所需要的仪器有铁架台、玻璃棒以及 (填字母序号),玻璃棒的作用是 .
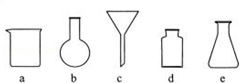
(4)(NH4)2SO4与KCl溶液需在浓氨水中发生反应Ⅱ,析出K2SO4晶体.此反应的基本类型是 ,浓氨水的作用是 ,反应Ⅱ需在密闭容器中进行的原因是 .
(5)该工艺可以循环利用的物质有 (写一种),副产品NH4Cl与NaOH溶液混合微热,产生的气体能使湿润的红色石蕊试纸变 色.

请回答下列问题:
(1)石膏中S的化合价是 .脱硫过程的化学方程式为2CaCO3+2SO2+O2+4H2O=2CaSO4?2H2O+2 .
(2)石膏与饱和(NH4)2CO3溶液相混合,发生反应Ⅰ时需不断搅拌,其目的是 .
(3)实验室完成过滤操作所需要的仪器有铁架台、玻璃棒以及 (填字母序号),玻璃棒的作用是 .
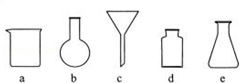
(4)(NH4)2SO4与KCl溶液需在浓氨水中发生反应Ⅱ,析出K2SO4晶体.此反应的基本类型是 ,浓氨水的作用是 ,反应Ⅱ需在密闭容器中进行的原因是 .
(5)该工艺可以循环利用的物质有 (写一种),副产品NH4Cl与NaOH溶液混合微热,产生的气体能使湿润的红色石蕊试纸变 色.
(1)+6,CO2;(2)使原料充分反应,提高原料利用率;(3)ac,引流;(4)复分解,降低硫酸钾的溶解度,利于硫酸钾的析出,浓氨水易挥发;(5)碳酸钙,蓝.
试题分析:(1)在CaSO4?2H2O中,由于钙显+2价、氧显﹣2价、氢显+1价,所以,硫显+6价.由质量守恒定律反应前后原子的种类及数目不变可知,应填入的物质是CO2;
(2)石膏与饱和(NH4)2CO3溶液相混合,发生反应Ⅰ时需不断搅拌,其目的是使原料充分反应,提高原料利用率;
(3)实验室完成过滤操作所需要的仪器有铁架台、玻璃棒以及烧杯和漏斗,玻璃棒的作用是引流;
(4)(NH4)2SO4与KCl溶液需在浓氨水中发生反应Ⅱ,析出K2SO4晶体,生成了氯化铵,是两种化合物相互交换了成分生成了另外两种化合物,属于复分解反应.由于浓氨水易挥发出氨气带走了大量的热,降低硫酸钾的溶解度,利于硫酸钾的析出,为了防止氨气挥发,反应Ⅱ需在密闭容器中进行;
(5)由反应的流程可知,该工艺可以循环利用的物质是碳酸钙,由于NH4Cl与NaOH溶液混合微热,产生了氨气,氨气的水溶液显碱性,能使湿润的红色石蕊试纸变蓝色.
点评:本题通过物质的转化和制备,考查的知识点较多,只有全面地掌握有关的知识,才能解决好本题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 .
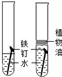
.
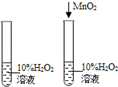
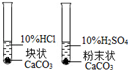
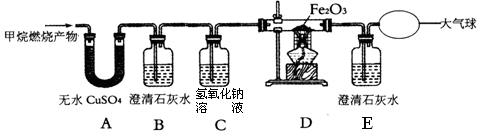



 2Fe+3CO2,请写出反应器中一氧化碳是如何产生的化学方程式: 。
2Fe+3CO2,请写出反应器中一氧化碳是如何产生的化学方程式: 。