题目内容
【题目】聚合硫酸铁(PFS)是一种新型的饮用水处理剂和城市污水净化剂,其化学组成可表示为[Fex(OH)y(SO4)z]m。某中学化学兴趣小组以聚合硫酸铁的生产流程和相关性质进行了一系列的探究。
Ⅰ.聚合硫酸铁的工业生产。
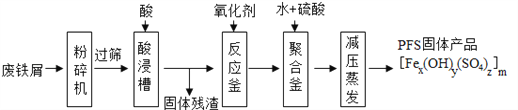
如图是以回收废铁屑为原料制备PFS的一种工艺流程。
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为______。“过筛”与化学实验中的______原理相似(填操作名称)。
(2)酸浸时最合适的酸是______,写出铁锈与该酸反应的化学反应方程式______。
(3)反应釜中加入氧化剂的作用是将Fe2+转化为Fe3+。你认为下列氧化剂中最合适的是
______(填标号),原因是______。
A.KMnO4 B.Cl2 C.H2O2 D.HNO3
(4)相对于常压蒸发,减压蒸发的优点是______。
A.有利于水分蒸发 B.降低沸点,防止晶体分解 C.降低生产成本
Ⅱ.聚合硫酸铁的成分探究。
该研究小组为确定聚合硫酸铁的化学式,进行了如下实验:
①称取5.52 g聚合硫酸铁样品溶于足量的稀盐酸中并充分混合;
②向①所得的混合物中加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、干燥、称重,得沉淀4.66 g。
③若向步骤②的滤液中加入过量的NaOH溶液,充分反应后,再将沉淀过滤、洗涤、灼烧、称重,得固体3.20 g。
则聚合硫酸铁[Fex(OH)y(SO4)z]m样品中的x:y:z的值为______。
试写出该聚合硫酸铁与盐酸的反应方程式______。
Ⅲ.聚合硫酸铁的热分解气体产物成分探究。
该小组将5.52 g聚合硫酸铁在一定条件下加热完全分解,对所得气体产物进行实验探究。(已知SO3的熔点为16.8℃)。
【提出假设】
假设1:所得气体的成分是SO3;
假设2:所得气体的成分是SO2、O2;
假设3:所得气体的成分是______。
【设计实验】
按下图装置进行实验。
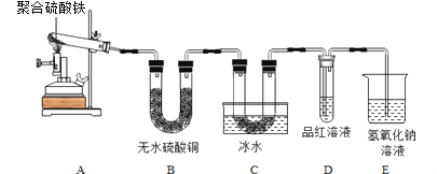
实验过程中发现:B中无水硫酸铜变蓝,C中U形管内有无色晶体析出,D中品红溶液褪色,装置E的作用是______。
【实验结论】
通过实验现象判断,假设______成立。
如果最终试管中固体为一种红棕色纯净物,则质量为______。
【答案】 三氧化二铁 过滤 稀硫酸 Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O C 不引入其他杂质 AB 2:4:1 3[Fe2(OH)4SO4]m + 12m HCl = m Fe2(SO4)3 + 4m FeCl3 + 12m H2O SO3、SO2、O2 吸收多余的二氧化硫,防止污染空气 3 3.2 g
【解析】根据所学知识和题中信息知,Ⅰ.聚合硫酸铁的工业生产。(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为三氧化二铁。“过筛”与化学实验中的过滤原理相似。(2)酸浸时最合适的酸是稀硫酸,铁锈与该酸反应的化学反应方程式是Fe2O3 + 3H2SO4 = Fe2(SO4)3 +3H2O 。(3)反应釜中加入氧化剂的作用是将Fe2+转化为Fe3+。下列氧化剂中最合适的是C.H2O2 ,原因是不引入其他杂质。(4)相对于常压蒸发,减压蒸发的优点是A.有利于水分蒸发。 B.降低沸点,防止晶体分解。Ⅱ.聚合硫酸铁的成分探究。聚合硫酸铁[Fex(OH)y(SO4)z]m样品中的x:y:z的值为∶根据化合物中正负化合价代数和为零原则,3x=y+2z, x:y:z的值为2:4:1 。该聚合硫酸铁与盐酸的反应方程式是. 3[Fe2(OH)4SO4]m + 12m HCl = m Fe2(SO4)3 + 4m FeCl3 + 12m H2O 。Ⅲ.聚合硫酸铁的热分解气体产物成分探究。【提出假设】假设1:所得气体的成分是SO3;假设2:所得气体的成分是SO2、O2;假设3:所得气体的成分是SO3、SO2、O2。实验过程中发现:B中无水硫酸铜变蓝,C中U形管内有无色晶体析出,D中品红溶液褪色,装置E的作用是吸收多余的二氧化硫,防止污染空气。【实验结论】通过实验现象判断,假设3成立。如果最终试管中固体为一种红棕色纯净物,则质量为3.2 g。
点睛∶本题主要考查聚合硫酸铁的工业生产,聚合硫酸铁的成分探究,聚合硫酸铁的热分解气体产物成分探究。

【题目】甲烷是最简单的有机物,实验室常用加热无水醋酸钠和碱石灰的固体混合物制取甲烷。在标准状况下,甲烷的密度比空气密度小,难溶于水。某实验小组准备了下列器材进行甲烷的制取和收集实验。

(1)在图A所示的装置中,仪器①的名称是___________。
(2)实验室中制取并收集比较纯净的甲烷可选用下列仪器中的_______和______。(填编号)
(3)请你设计实验,检验生成的气体甲烷中含有氢元素。
实验操作 | 实验现象 | 实验结论 |
______ | _____ | 甲烷中含有氢元素 |
【题目】下列广告词对应商品的主要成分及类别不正确的是
选项 | 广告词 | 商品 | 主要成分 | 类别 |
A. | “衡水老白干,喝出男人味” | 白酒 | 乙醇 | 有机物 |
B. | “特别的味,给特别的您” | 凤利酥 | 淀粉 | 蛋白质 |
C. | “补钙新一代,骨康都期待” | 补钙剂 | 碳酸钙 | 盐 |
D. | “农夫山泉有点甜” | 矿泉水 | 水 | 化合物 |
A. A B. B C. C D. D