题目内容
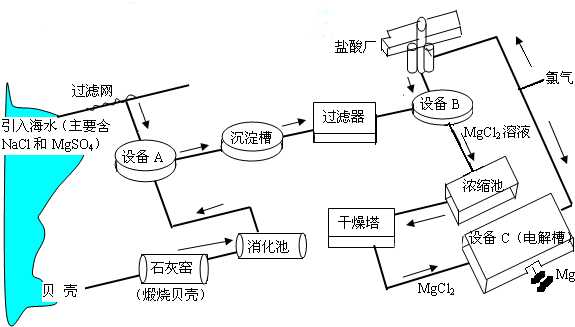
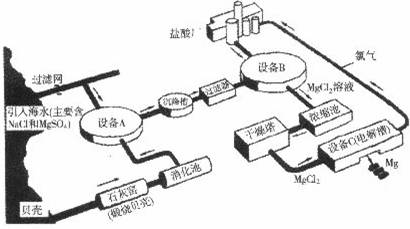
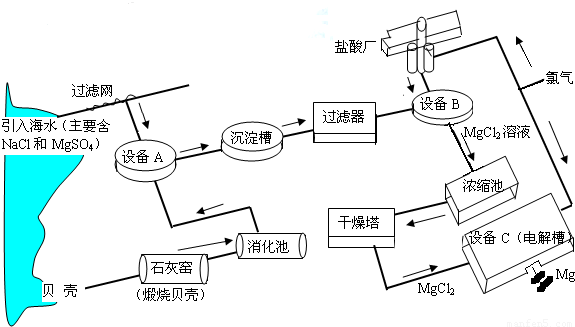
海水中镁的含量一般为1.28g?L-1,总储量约为2×1015t,某镁冶炼厂利用海水制镁,其工业流程如下:
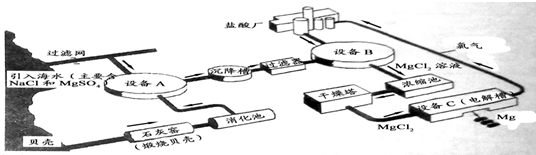
根据上述流程图,回答下列问题:石灰窑中发生反应的化学方程式为________.
消化池中发生的反应CaO+H2O=Ca(OH)2,消化池的周围有较多明显的安全警示标志,严禁非专业人员进入,其原因是________;写出设备A和B中反应的化学方程式A:________;B:________.
设备C中产生的氯气不能排放到空气中,而要循环使用,其原因是:①氯气有毒,排入空气会污染环境;②________.
CaCO3 CaO+CO2↑ 氧化钙与水反应放出大量的热,容易灼伤人 MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓ Mg(OH)2+2HCl═MgCl2+2H2O 氯气可以用来制盐酸节省原料
CaO+CO2↑ 氧化钙与水反应放出大量的热,容易灼伤人 MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓ Mg(OH)2+2HCl═MgCl2+2H2O 氯气可以用来制盐酸节省原料
分析:根据方程式的写法、生石灰与水结合时放出大量的热,氯气可以作为制取盐酸的原料来回答本题.
解答:石灰窑中发生反应的反应物是碳酸钙,生成物是氧化钙和二氧化碳,二氧化碳后面标上上升符号,反应条件是高温写在等号的上边;因为氧化钙与水反应时放出大量的热,防止人进入后被灼伤;设备A中反应物是硫酸镁和氢氧化钙,生成物是硫酸钙和氢氧化镁,直接平了,氢氧化镁后面标上沉淀符号;设备B中反应物是氢氧化镁和盐酸,生成物是氯化镁和水,用观察法配平.设备C中产生的氯气不能排放到空气中,而要循环使用,其原因是①氯气有毒,排入空气会污染环境;②氯气可以用来制盐酸节省原料.
故答案为:CaCO3 CaO+CO2↑;氧化钙与水反应放出大量的热,容易灼伤人;MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓;Mg(OH)2+2HCl═MgCl2+2H2O;氯气可以用来制盐酸节省原料.
CaO+CO2↑;氧化钙与水反应放出大量的热,容易灼伤人;MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓;Mg(OH)2+2HCl═MgCl2+2H2O;氯气可以用来制盐酸节省原料.
点评:解答本题要知道制取镁的思路是:先用碳酸钙高温制取氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙与硫酸镁反应生成氢氧化镁沉淀,用盐酸将氢氧化镁沉淀溶解,再获得纯净的氯化镁,再通电电解得到镁.
 CaO+CO2↑ 氧化钙与水反应放出大量的热,容易灼伤人 MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓ Mg(OH)2+2HCl═MgCl2+2H2O 氯气可以用来制盐酸节省原料
CaO+CO2↑ 氧化钙与水反应放出大量的热,容易灼伤人 MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓ Mg(OH)2+2HCl═MgCl2+2H2O 氯气可以用来制盐酸节省原料分析:根据方程式的写法、生石灰与水结合时放出大量的热,氯气可以作为制取盐酸的原料来回答本题.
解答:石灰窑中发生反应的反应物是碳酸钙,生成物是氧化钙和二氧化碳,二氧化碳后面标上上升符号,反应条件是高温写在等号的上边;因为氧化钙与水反应时放出大量的热,防止人进入后被灼伤;设备A中反应物是硫酸镁和氢氧化钙,生成物是硫酸钙和氢氧化镁,直接平了,氢氧化镁后面标上沉淀符号;设备B中反应物是氢氧化镁和盐酸,生成物是氯化镁和水,用观察法配平.设备C中产生的氯气不能排放到空气中,而要循环使用,其原因是①氯气有毒,排入空气会污染环境;②氯气可以用来制盐酸节省原料.
故答案为:CaCO3
 CaO+CO2↑;氧化钙与水反应放出大量的热,容易灼伤人;MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓;Mg(OH)2+2HCl═MgCl2+2H2O;氯气可以用来制盐酸节省原料.
CaO+CO2↑;氧化钙与水反应放出大量的热,容易灼伤人;MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓;Mg(OH)2+2HCl═MgCl2+2H2O;氯气可以用来制盐酸节省原料.点评:解答本题要知道制取镁的思路是:先用碳酸钙高温制取氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙与硫酸镁反应生成氢氧化镁沉淀,用盐酸将氢氧化镁沉淀溶解,再获得纯净的氯化镁,再通电电解得到镁.

练习册系列答案
相关题目