题目内容
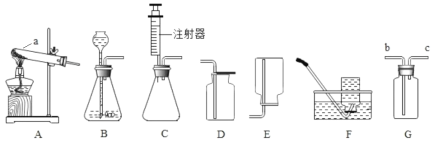
【题目】下图是实验所用的仪器,将以下实验所用仪器的名称填在横线上。
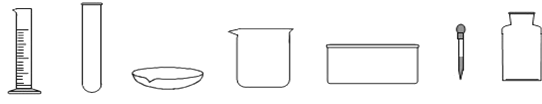
(1)用作大量液体间的反应容器,常用____________;
(2)用排水法收集气体时,常用___________、____________;
(3)用量筒量取8ml液体时,常用___________、____________;
(4)少量溶液相互发生反应时,常用_____________。
【答案】烧杯水槽、集气瓶量筒、胶头滴管试管
【解析】
(1)用作较大量试剂的反应容器是烧杯;
(2)用排水法收集气体时,需要用水槽和集气瓶;
(3)量取8.0mL液体,应选用与8.0毫升相近的量程,则应选10毫升量程的量筒,量取液体的最后不足的要用胶头滴管添加;
(4)少量溶液相互反应时,需要用试管。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组的同学为了测定实验室中氯酸钾(KClO3)样品的纯度,取一定量该样品与1g二氧化锰混合,其总质量为6g,依次加热该混合物T1、T2、T3、T4时间后,分别冷却称量剩余固体质量,记录的有关数据如表
(样品中的杂质不参与化学反应:有关方程式: 2KClO3 ![]() 2KCl+3O2↑)
2KCl+3O2↑)
加热时间 | T1 | T2 | T3 | T4 |
剩余固体质量/g | 4.24 | 4.16 | 4.08 | 4.08 |
(1)氯酸钾中钾、氯、氧元素的质量比为______;
(2)完全反应后产生氧气的总质量为______;
(3)计算氯酸钾样品中氯酸钾的质量分数_______.(写出计算过程)
【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
【假设】H2O2生成O2的快慢与催化剂种类有关。
【实验方案】常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
【进行实验】右下图是他们进行实验的装置图,气体发生装置中A仪器的名称是_____________,此实验中B处宜采用的气体收集方法是_______ _____。
【实验记录】
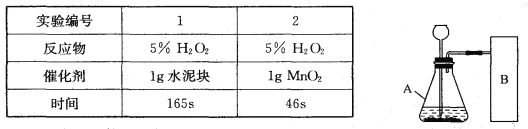
【结论】该探究过程得出的结论是_________________________。
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快。若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____ _____是否改变。
【实验拓展】H2O2生成O2的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
取一支试管加入3mL5%的过氧化氢溶液,然后加入少量二氧化锰。 | 缓慢有少量气泡冒出 | |
另取一支试管加入3mL15%的过氧化氢溶液,然后加入少量二氧化锰。 | 迅速有大量气泡冒出 |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
温度越高,过氧化氢分解的速率越大 |
【题目】下列方框内是对某一主题知识的描述.其内容全部正确的一组是( )
安装燃气热水器———定要配有烟道 预防煤气中毒———–室内放一盆水 劣质装饰材料—甲醛等超标致室内污染 |
减少汽车尾气污染——使用乙醇汽油 深埋丢弃废旧电池——造成水土污染 大理石雕塑被腐蚀——温室效应所致 |
食用水果蔬菜———–可补充维生素 食用“加铁酱油”———可预防贫血 食用加碘盐———可预防甲状腺肿大 |
氮气———-可做焊接金属的保护气
油罐车尾铁链——–防静电引燃油料 |
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
【题目】现甲、乙两化学小组安装两套如下相同装置,通过测定产生相同体积气体所用时间长短探究影响过氧化氢(H2O2)分解速率的因素
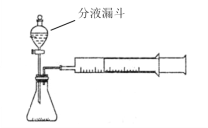
(1)检查此装置气密性的方法是:________________。
(2)甲小组有如下实验设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 探究浓度对H2O2分解速率的影响 | 25℃ | 二氧化锰0.2g | _____2%H2O2溶液 |
甲组实验Ⅱ | _____ | 二氧化锰0.2g | 10mL 5%H2O2溶液 |
(3)甲、乙两小组得出如图数据。
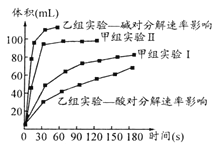
①甲组实验得出的数据可知浓度越大,H2O2分解速率 ___________ ;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下H2O2在________(填“酸”或“碱”)性环境下放出气体速率较快。