题目内容
【题目】人类是生活离不开水,某生活污水主要含有碎菜叶、碎塑料薄膜、泥沙、氯化钠和碳酸钠等物质.现欲将其经去渣处理后作为清洗厕所的用水.请问:
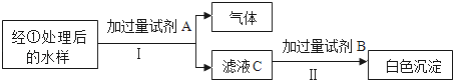
(1)捡掉污水中的碎菜叶、碎塑料薄膜等较大的固体后,可对污水进行________操作除去其中捡不掉的固体物质;把生活污水进行处理再利用的目的是________;
(2)①试剂A的化学式是________,试剂A加入过量的作用是________;
②写出步骤Ⅱ所发生反应的化学方程式________;如果步骤Ⅰ先加入试剂B,步骤Ⅱ加入过量试剂A,也能达到检验氯化钠的目的,理由是________.
【答案】过滤节约水资源HNO3除净碳酸钠NaCl+AgNO3═AgCl↓+NaNO3碳酸银沉淀能溶于硝酸,氯化银沉淀不能溶于硝酸
【解析】
(1)除去其中检不掉的固体物质即对不溶性固体与液体形成的混合物进行分离,分离操作自然应为过滤;生活污水进行处理再利用是一水多用,可节约水资源;
(2)经①处理后的水中含有氯化钠和碳酸钠等可溶性物质,为避免碳酸钠对氯化钠检验的影响,实验中应先加入对后面实验不产生影响的稀硝酸,进行处理时放出气体为二氧化碳,加入过量稀硝酸以彻底除去碳酸钠,处理后再滴加硝酸银,发生反应的化学方程式为NaCl+AgNO3═AgCl↓+NaNO3,以检验氯化钠的存在;氯化银沉淀既不溶于水也不溶于酸,碳酸银沉淀不溶于水,能溶于酸,如果先滴加硝酸银再滴加稀硝酸,滴加硝酸银时出现白色沉淀可能为碳酸银也可能为氯化银,此时还不能说明含氯化钠,需要待加入稀硝酸后,若沉淀不消失可判断沉淀为氯化银,也能说明含有氯化钠。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案【题目】长时间使用的热水壶底部有一层水垢,主要成分是CaCO3和Mg(OH)2。学校化学研究性学习小组同学通过实验想测定水垢中CaCO3的含量为多少。他们取200g水垢,加入过量的稀盐酸,同时测量5分钟(min)内生成CO2质量,测量数据如下表:
时间/ min | 1 | 2 | 3 | 4 | 5 |
生成CO2的质量/g | 30 | 50 | 60 | 66 | 66 |
(1)4 min后,水垢中的CaCO3________ (是、否)反应完全。
(2)计算该水垢中CaCO3的质量分数?