题目内容
【题目】某同学做了如下图所示的实验,在14.6%的稀盐酸中加入碳酸钙,后加入10.6%的碳酸钠溶液
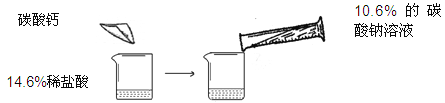
第一次 | 第二次 | |
14.6%的稀盐酸的质量 | m | m |
加入碳酸钙的质量 | 10g | 20g |
加入10.6%的碳酸钠溶液的质量 | 100g | 200g |
加入碳酸钠溶液后,实验现象 | 只有气泡 | 只有白色沉淀 |
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题
写出实验一中发生化学反应的方程式
第一次实验中加入碳酸钙后溶液中溶质成分
根据已知条件列出求解第二次实验生成沉淀的质量的比例式
实验中加入稀盐酸m的质量为
若若用溶质质量分数29.2%的浓盐酸配置实验二所需的稀盐酸,则需要加水的质量
将第二次反应后的溶液蒸发191.2g水,则所得不饱和溶液中溶质的质量分数为 。
【答案】(1)CaCO3+2HCl=CaCl2+H2O+CO2↑(2)氯化钙、氯化氢(3)106:100=21.2g:X (4)100g (5) 100g (6) 23.4%
【解析】
试题分析:(1)实验一:稀盐酸和碳酸钙反应,方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑(2)第一次实验加入碳酸钠溶液后产生气泡,所以稀盐酸过量,即(2) 第一次实验中加入碳酸钙后溶液中溶质成分为:氯化钙和盐酸;(3)根据在化学反应中各物质质量成比例;所以第二次实验生成沉淀的质量的比例式为:106:100=21.2g:X(4)恰好与20g碳酸钙反应需要盐酸的质量为14.6g,所以需要盐酸溶液的质量为:14.6g/14.6%=100g;(5)用溶质质量分数29.2%的浓盐酸配置实验二所需的稀盐酸,根据溶液稀释前后溶质的质量不变:设用29.2%的浓盐酸配置实验所需的14.6%的稀盐酸,则需要加水的质量为X,则200g*14.6%=(200g-X)*29.2% 解得:X=100g;(6)将第二次反应后的溶液蒸发191.2g水,则所得不饱和溶液中溶质的质量分数为:23.4g/(200g+100g-8.8g-191.2g)*100%=23.4%。