题目内容
【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如下图),化学小组的同学经过寻问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:![]()
【进行猜想】
猜想I:原溶液的溶质是NaCl;
猜想II:原溶液的溶质是NaOH;
猜想III:原溶液的溶质是Na2CO3;
猜想IV:原溶液的溶质是NaHCO3 .
(1)【查阅资料】
常温下,有关物质的相关信息如下表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,原溶液的溶质一定不是NaHCO3 , 因为 .
(2)【进行实验】
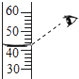
取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是 .
(3)同学们另取样品又进行了如下实验,实验过程如下: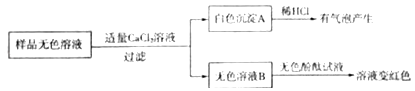
①生成白色沉淀A的化学方程式 .
②通过实验可以判断样品无色溶液中含有的溶质有
(4)【获得结论】
实验完成后,最终得到的结论:原瓶中的溶质是 , 且已变质.
【答案】
(1)碳酸氢钠的饱和溶液溶质质量分数在该温度下不能达到10%
(2)NaCl
(3)Na2CO3+CaCl2=CaCO3↓+2NaCl;NaOH、Na2CO3
(4)NaOH
【解析】解:【查阅资料】根据计算可以知道在20℃时饱和碳酸氢钠的质量分数为: ![]() ×100%=8.8%<10%,所以能够排除碳酸氢钠;碳酸氢钠的饱和溶液溶质质量分数在该温度下不能达到10%;
×100%=8.8%<10%,所以能够排除碳酸氢钠;碳酸氢钠的饱和溶液溶质质量分数在该温度下不能达到10%;
【进行实验】(2)测定溶液的pH大于7,而氯化钠溶液呈中性,pH等于7所以不可能是氯化钠,故填:NaCl;(3)①过量的氯化钙可以检验并除尽碳酸钠,碳酸钠可以和氯化钙反应生成碳酸钙沉淀和氯化钠,产生白色沉淀的化学方程式是Na2CO3+CaCl2=CaCO3↓+2NaCl;Na2CO3+CaCl2=CaCO3↓+2NaCl;
②滴加无色酚酞,滤液变红,说明溶液呈碱性,还有氢氧化钠,实验可以判断原无色溶液中含有的溶质有NaOH、Na2CO3;NaOH、Na2CO3;
【获得结论】该瓶原来装的无色溶液的溶质是NaOH,并且部分变质;NaOH.
【考点精析】掌握书写化学方程式、文字表达式、电离方程式是解答本题的根本,需要知道注意:a、配平 b、条件 c、箭号.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案