��Ŀ����
�٣���֪HnRO2n����Է�������ΪA, ��R�����ԭ������Ϊ ��
�ڣ�ij�����ﺬ��Ԫ�ص���������Ϊ20%,��֪ÿ����������2����ԭ�ӣ������������Է��������� ��
�ۣ����к����������У���Ԫ�ػ��ϼ��ɸߵ��͵�����˳���� ��
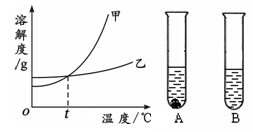
������� ������ �۵��� �ܶ������� ������������ ��һ������
�ܣ����˲������õ��IJ��������� ��
�ݣ�1996��,��ѧ���������������H3+��H3����, 1��H3+�����к��� �����Ӻ� �����ӡ�H3���� (������,����,����)
�٣�x=A-33n���ڣ�160���ۣ��ݢڢܢޢۢ٣��ܣ�����̨��©�����ձ����������ȣ��ݣ�3��2�����ʣ�
��������������٣�������Է���������ʽ����Ϊ���ɷ��ӵĸ�ԭ�ӵ����ԭ������֮�ͣ�ij������Ļ�ѧʽΪHnRO2n����֪��ʽ����A����R�����ԭ������Ϊx����1��n+x+16��2n=A����x=A-33n���ڣ� ������һ��Ԫ��ΪR�����RO2����Է���������������Ԫ�ص���������Ϊ20%�������������ļ���ʽ������û��������Է�����������RO2����Է�������x��
��������RO2�к���Ԫ�ص���������Ϊ20%
��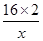 ��100%=20%
��100%=20%
���x=160
������������Է�������Ϊ160��
�ۣ� ��ĿҪ���ϼ۸ߵ���������Ҫ���û��ϼ۹���������������Ҫ����Ϥ����Ԫ�صĻ��ϼۣ���𣺽⣺���漰����Ԫ������-2�ۣ���+1�ۣ���+6�ۣ����ݻ��ϼ۴�����Ϊ�㣬��εĻ��ϼ�Ϊx,��
(NH4)2SO4 (x+(+1)*4)*2+(+6)+(-2)*4=0����x=-3��
HNO3 (+1)+x+(-2)*3=0����x=+5��
N2 ������Ԫ�صĻ��ϼ�Ϊ�㣬��x=0��
NO2 x+(-2)*2=0����x=+4��
NO3 x+(-2)*3=0����x=+6��
NO x+(-2)=0����x=+2��
�ʴ�Ϊ�� �ݢڢܢޢۢ�
�ܣ����ݹ��˲�����ԭ����ʹ�õ��������з��������˲��õ�������������̨��©�����ձ����������ȣ�
�ݣ�Ԫ�ط������½ǵ����ֱ�ʾ1�����ӻ�ԭ����������ij��ԭ�ӵĸ�������ԭ���к������������ں������������������ʧȥ�����γɵģ��������������ʧȥ���ӵ���Ŀ��������ͬ��Ԫ����ɵĴ����1��H3+����3����ԭ�ӣ�������1����λ������ɣ�1����ԭ�Ӻ���1�����Ӻ�1�����ӣ����3����ԭ�Ӵ���3�����Ӻ�3�����ӣ����ڴ���1����λ������ɣ�˵��ʧȥ��1�����ӣ����1��H3+������3�����Ӻ�2�����ӣ�H3ֻ����Ԫ����ɣ����ٺ�������Ԫ�أ����H3���ڵ��ʣ�
���㣺��Է��������ĸ������㣻�й�Ԫ�ػ��ϼ۵ļ��㣻Ԫ�ص������������㣮��ѧʽ����д�����壻����Ԫ���볣��ԭ���ŵĻ��ϼۣ����˵�ԭ������������Ӧ�ã���ѧ���ż�����Χ���ֵ����壻���ʺͻ�������б�

����˵����ȷ���ǣ� ��
| A�����е�ԭ�Ӷ��������ӣ����ӣ����ӹ��� |
| B��ԭ�Ӻ�ԭ�Ӻ˶������� |
| C�����ԭ�������ĵ�λ�ǿ� |
| D����ԭ����,���������ں˵���� |
�������Ӳ��Ե��Ե���
| A������ | B������ | C��ԭ�Ӻ� | D������ |
������С��ͬѧ���е�ʵ��������жϣ�������ȷ���ǣ�������
| | ���� | ���� | ���� |
| A | ȡ����Ũ��ˮ������ɫ��̪��Һ�� | ��ɫ��̪��Һ��� | ������������ͣϢ�����˶� |
| B | �õ�ñ��ȼ�ŵľƾ��� | ����Ϩ�� | ���¿������ |
| C | ��Ũ���������ʯ��Ϻ����������ͨ�����ʯ��ˮ�� | ����ʯ��ˮδ����� | ����ʯ��ˮ���� |
| D | ȡ��������������Һ���μ�ϡ���� | �������� | ����������Һ�Ѿ����� |
ˮ��ˮ��Һ������������������Ҫ���á�
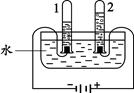
��1����ͼ���о�ˮ��ɵĵ��ˮʵ�顣ͼ�����Թ�A�������ǵ�Դ��________��������������������÷�Ӧ�Ļ�ѧ����ʽ��________________________��
��2�������ǵĺ�ˮ����ͼ��ʾ�ļ���ˮ�����о������������⣬����̿����Ҫ������________���õ���ˮ��________���������������������н���ˮ��Ӳ�ȿɲ��õķ�����________________��
��3����ˮ�Ǿ����Դ���⡣���ú�ˮ��ȡʳ�εĹ�������ͼ��ʾ��
�ٺ�ˮ�е��ܼ���________���Ӻ�ˮ����ȡ���Σ����õķ�����________��
�ڴ���Ҫ�����ᴿ�������ܵõ��Ȼ��ơ�ȥ�����������������ʣ���Ҫʵ�鲽���У�________�����ˡ��������ڹ��˲����У���������������________________��
�۸��ݺ�ˮɹ�ε�ԭ��������˵����ȷ����________������ţ���
| A����ˮ������ˮ�أ���ˮ�ijɷֻ������� |
| B���������أ���ˮ���Ȼ��Ƶ����������� |
| C���ڽᾧ�أ���ˮ���Ȼ������ʵ��������������� |
| D������������ĸҺ���Ȼ��Ƶı�����Һ |