题目内容
【题目】实验室模拟“侯氏制碱法”制纯碱,其原理是NaCl+NH4HCO3=NaHCO3+NH4Cl,再将碳酸氢钠加热分解得到纯碱.如图是NaCl、NH4Cl、NaHCO3的溶解度曲线,下列说法正确的是( ) 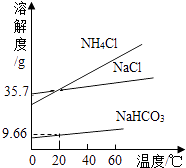
A.NaHCO3从溶液中分离出,可采用的操作是蒸发结晶
B.NH4Cl饱和溶液的溶质质量分数一定大于NaCl饱和溶液的溶质质量分数
C.40℃时,溶解度大小关系是:NH4Cl>NaCl>NaHCO3
D.20℃时,100g水中加入11.7g NaCl和15.8g NH4HCO3固体,充分反应后,理论上可析出7.14g NaHCO3晶体
【答案】CD
【解析】解:A、NaHCO3的溶解度较小,从溶液中分离出来可采用过滤方法,故A错误; B、饱和溶液的溶质质量分数取决于溶解度,比较两种固体物质的溶解度大小要在同一温度下进行,故B错误;
C、由图可以看出,40℃时,溶解度大小关系是:NH4Cl>NaCl>NaHCO3 , C正确;
D、根据反应方程式计算,11.7g NaCl和15.8g NH4HCO3固体完全反应能生成16.8g NaHCO3 , 20℃时NaHCO3的溶解度为9.66g,则析出固体的质量=16.8g﹣9.66g=7.14g,D正确.
故选CD.
【考点精析】本题主要考查了结晶的原理、方法及其应用和固体溶解度曲线及其作用的相关知识点,需要掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和)才能正确解答此题.

 名校课堂系列答案
名校课堂系列答案【题目】“鱼浮灵”主要成分是过碳酸钠(xNa2CO3yH2O2),俗称固体双氧水.兴趣小组对其进行以下探究: 【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条 , 说明有O2生成.
(2)取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有生成.
(3)结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质. 【工业制备】(如图)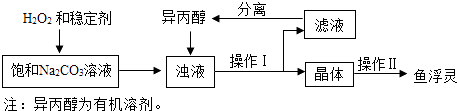
稳定剂的作用是;稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为 .
(4)浊液中加入异丙醇的作用是 .
(5)操作Ⅱ中洗涤晶体的试剂最好选用(填字母).
A.饱和NaCl溶液
B.水
C.异丙醇
D.稀盐酸
(6)根据如表数据,你认为上述制备反应的最佳温度范围是℃.
温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
“鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
注:活性氧含量是指产品中能转化为O2的氧元素的质量分数.
(7)【组成测定】利用如图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3yH2O2)组成的测定(杂质对测定无影响). 【查阅资料】①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.
②过碳酸钠能与酸反应放出CO2和O2 . 
实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2 , 其目的是 .
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值(填“偏大”或“偏小”).
(9)装置B的作用是(填序号) ①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为%;属于(填“一等品”或“合格品”);x:y= .