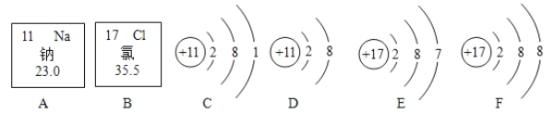
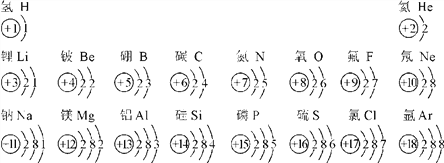
题目内容
【题目】某化学实验小组的同学作了如下实验,向点滴板上加入氢氧化钠溶液和氢氧化钙溶液,然后向氢氧化钠溶液中加入几滴酚酞溶液,向氢氧化钙溶液中加入一定量的稀盐酸,如图所示。
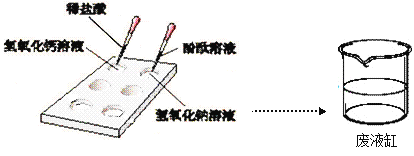
请你写出氢氧化钠溶液中加入酚酞溶液的现象(1)____________________________;氢氧化钙溶液中加入稀盐酸的化学方程式(2)__________________________________;
实验后同学们将所有的废液全部倒入废液缸中发现废液为无色,这一现象引起了同学们的注意,他们决定对废液缸中的成分进行探究。
【提出问题】:废液缸中的溶质是什么?(除酚酞以外)
【猜想与假设】:童童同学认为:NaCl CaCl2 HCl
婷婷同学认为:NaCl CaCl2 Ca(OH)2
小宇同学认为:NaCl CaCl2;
【交流与评价】:你认为(3)___________同学的猜想是错误的,原因(4)_______;童童同学为了证明自己的猜想,取少量废液于试管中,加入(5)________________观察到(6)__________________现象,证明自己的猜想是正确的。
通过上述探究我们可以得出在确定反应后溶液中溶质的成分时,除了要考虑溶于水的生成物和溶于水的剩余的反应物外,还可以根据(7)___________________来确定溶液中溶质的成分。
此探究实验中用到了点滴板,点滴板的作用是(8)____________________________。
【答案】 无色溶液变红色或无色酚酞溶液变红色 Ca(OH)2 + 2HCl = CaCl2 + 2H2O 婷婷 氢氧化钙溶液能使酚酞溶液变红,实验后废液呈无色,不能含有氢氧化钙,所以错 紫色石蕊溶液(合理即可) 紫色石蕊溶液变红;(合理即可) 实验现象 同时进行多组对比实验或便于观察实验现象或节约药品(合理即可)
【解析】(1)氢氧化钠溶液显碱性,可使无色溶液变红色;(2)氢氧化钙溶液中加入稀盐酸生成氯化钙和水,化学方程式为Ca(OH)2 + 2HCl = CaCl2 + 2H2O;
【交流与评价】氢氧化钙溶液能使酚酞溶液变红,实验后废液呈无色,不能含有氢氧化钙,所以婷婷的猜想错误;要证明童童同学的猜想,也就是证明溶液显酸性,可以取少量废液于试管中,加入紫色石蕊溶液等观察到现象紫色石蕊溶液变红,证明猜想是正确的。
在确定反应后溶液中溶质的成分时,除了要考虑溶于水的生成物外还要考虑溶于水剩余的反应物,可以通过实验现象来确定溶液中溶质的成分。
点滴板可以同时进行多组对比实验,便于观察实验现象,节约药品。

 阅读快车系列答案
阅读快车系列答案【题目】课外兴趣小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
(1)【假 设】1、H2O2 生成O2 的快慢与催化剂种类有关
【实验方案】常温下,在两瓶同质量、同浓度的H2O2 溶液中,分别加入相同质量的MnO2 和水泥块,测量各生成一瓶(相同体积)O2 所需的时间。
(2)【进 行 实 验】下图是他们进行实验的装置图。请写出过氧化氢在二氧化锰的催化下发生反应的符号表达式________________________________。在B位置最好选用_________ 法来收集氧气(选填“向上排空气法”或“排水法”),长劲漏斗下端管口应插在______(选填“液面上”或“液面下”)。
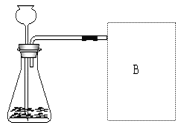
(3)【 实验记录】
实验编号 | 1 | 2 |
反应物 | 5%H2O2 | 5%H2O2 |
催化剂 | 1g水泥块 | 1gMnO2 |
时间 | 165秒 | 46秒 |
(4)【 结 论】该探究过程得出的结论是__________________________________。
(5)【 反 思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快,若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的 ____________________是否改变。