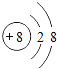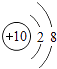题目内容
【题目】(1)某钢铁厂若消耗500 t含Fe2O3 96%的赤铁矿石,该厂理论上可生产含Fe 98%的生铁________t。(结果保留一位小数)
(2)用上述得到的生铁与足量的废硫酸反应,可得硫酸亚铁的质量是________t。
【答案】 342.9 912
【解析】(1)500 t含Fe2O3 96%的赤铁矿石中氧化铁的质量为:500t×96%=480t,设该厂理论上可生产的生铁中铁的质量是x。
Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
160 112
480t x
![]() =
=![]() ,解得x=336t,生铁的质量为:336t÷98%=342.9t
,解得x=336t,生铁的质量为:336t÷98%=342.9t
(2)设可得硫酸亚铁的质量为y。
Fe+ H2SO4 == FeSO4 + H2↑
56 152
336t y
![]() =
=![]() ,解得y=912t
,解得y=912t

练习册系列答案
相关题目
【题目】如图为元素周期表中某一周期元素的原子结构示意图,请回答下列问题:
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
(1)该周期中一共有种金属元素;
(2)磷原子的结构示意图中,X=;
(3)表中具有相对稳定结构的元素是;
(4)在化学反应中,铝原子失去电子形成的微粒的符号是;
(5)镁元素与氯元素组成的化合物的化学式为;
(6)上述元素在周期表中处于同一周期的原因是。