题目内容
【题目】某化学兴趣小组在一次实验活动中发现钠能在二氧化碳中燃烧,他们对钠在二氧化碳气体中燃烧后生成的白色物质进行了如下探究:
实验:将燃烧的钠迅速伸入到盛满二氧化碳的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质。
查资料:Na2O+H2O=2NaOH
提出假设:燃烧后瓶璧上附着的白色物质是什么?
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3
假设3: 。
设计实验方案,验证假设
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质是Na2O。 |
方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量BaCL2 | 有白色沉淀生成 | 白色物质是Na2CO3 |
②静置片刻,取上层清液于试管中…… | …… |
思考与交流:
(1)甲同学认为方案1得到的结论不正确,其理由是
(2)根据方案2的结论,补齐方案2中②的实验操作,并写出相应的实验现象。
实验操作:
实验现象:
(3)乙同学认为白色物质可能是NaOH,你填 (同意或不同意)该同学的观点,
并简述理由:
(4)根据假设2,写出钠在二氧化碳中燃烧的化学方程式: 。
【答案】假设3:白色物质可能是 Na2O和 Na2CO3 的混合物
(1)Na2CO3 的水溶液显碱性,遇酚酞变红色。
(2)滴加酚酞试液;溶液颜色没有变化(上层清液是NaCl显中性)
(3)不同意;反应物中无氢元素,违背质量守恒定律。
4 Na+3CO2![]() 2 Na2CO3+C
2 Na2CO3+C
【解析】
试题分析:钠在二氧化碳气体中燃烧后生成的白色物质,根据质量守恒定律,反应前后各种元素的种类不变.反应前的元素为:碳元素、氧元素和钠元素;反应后生成的物质就应该只能由这三种元素组成。由这三种元素组成的白色物质有:Na2O和Na2CO3;因此对这三种物质进行猜想时,有三种可能:①白色物质是Na2O;②白色物质是Na2CO3;③白色物质是白色物质可能是 Na2O和Na2CO3的混合物.故答案为:白色物质可能是Na2O和Na2CO3的混合物;
(1)“取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液,溶液变成红色”,得出“白色物质是Na2O”是不严密的,白色物质也可能是Na2CO3或者是Na2O和Na2CO3,因为Na2CO3的水溶液也呈碱性,滴加酚酞溶液,溶液也会变成红色;
(2)由方案2中的结论为:“白色物质是Na2CO3”,当加入溶液后发生反应,生成碳酸钡和氯化钠,其反应的化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl;如果白色物质中还含有Na2O,Na2O会和水反应生成氢氧化钠,由化学方程式为:Na2O+H2O=2NaOH;由第一个化学方程式可看出:静置片刻,上层清液中的物质是NaCl,只要证明是NaCl而不是NaOH就可以了.因此可以滴加酚酞试液,溶液颜色没有变化就可以了;(证明上层清液是NaCl,显中性);
(3)根据质量守恒定律,反应前后各种元素的种类不变.钠在二氧化碳中燃烧,反应前的元素为:碳元素、氧元素和钠元素;反应后生成的物质就应该只能由这三种元素组成.而NaOH由Na、O和H元素组成,反应前反应物中不含氢元素所以该同学的观点是错误的;
(4)由上面的结论可以看出钠在二氧化碳中燃烧,生成的白色物质是Na2CO3,和另外一种黑色物质,这种黑色物质中含有Na、C和O三种元素中的一种或多种,由于是黑色的,可以判定其为碳。所以化学方程式为:4Na+3CO2![]() 2Na2CO3+C。
2Na2CO3+C。

【题目】如图所示,现有甲、乙、丙、X、Y、Z六种物质,其中连线两端的甲、乙、丙溶液两两之间能发生反应;X、Y、Z之间只通过一步反应就能实现如箭头所指方向的转化.下列符合上述要求的一组物质是

甲 | 乙 | 丙 | X | Y | Z | |
A | HCl | NaOH | Na2CO3 | Cu | CuO | CuSO4 |
B | HCl | Ba(OH)2 | Na2CO3 | H2O2 | H2O | O2 |
C | H2SO4 | NaOH | K2CO3 | C | CO | CO2 |
D | H2SO4 | Ba(OH)2 | K2CO3 | CaO | Ca(OH)2 | CaCO3 |
【题目】(5分)某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:
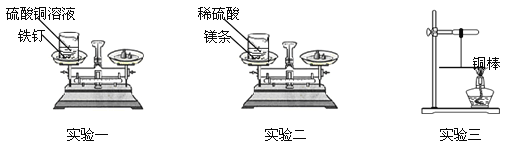
【设计并实验】
实验一:将盛有硫酸铜溶液的烧杯和铁钉一起放在托盘天平上称量,记录所称的质量。然后将铁钉浸到硫酸铜溶液中,观察现象。待反应一段时间后溶液颜色改变时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验二:将盛有稀硫酸的烧杯和镁条一起放在托盘天平上称量,然后将镁条浸到稀硫酸中,观察现象。待反应一段时间后不再放出气泡时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验一和实验二的数据见下表:
编 号 | 实验一 | 实验二 |
反应前/g | 118.4 | 112.6 |
反应后/g | 118.4 | 112.4 |
实验三:用细线系住铜棒中点使之平衡,然后在铜棒一端用酒精灯加热。加热一段时间后,观察到铜棒的平衡情况是 。
【分析与讨论】
(1)在这三个实验中,你认为:实验 正确反映了反应物与生成物之间的质量关系,由此得出的结论是:在化学反应中生成物的总质量与反应物的总质量相等,请从原子的角度分析结论正确的理由是 。
(2)另外两个实验得出的结论是:在化学反应中生成物的总质量与反应物的总质量不相等,你认为导致这一结论错误的原因是 (只写其中一个实验的原因即可)。
【实验反思】小组成员从不能正确反映反应物和生成物之间质量关系的两个实验中,找出了实验设计中的不当之处,并达成了以下共识:设计实验验证质量守恒定律时,对于有空气中的气体(成分)参与或有气体生成的化学反应,一般应使反应在 中进行。