题目内容
【题目】实验室部分装置如图所示,请回答下列问题。

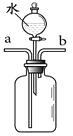
(1)仪器X的名称是 。
(2)实验室用CaCO3和稀盐酸制备CO2的化学方程式为 ,若需制备22g CO2,不计实验损耗,至少需要消耗 g CaCO3。
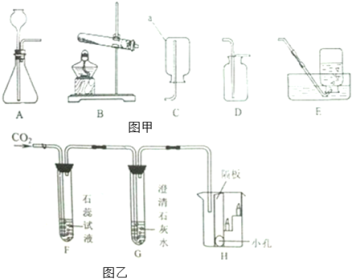
(3)①用大理石和稀盐酸制取CO2时,能作为发生装置的是 、 (填字母,下同)。
②若要制备多瓶CO2,并在制取过程中便于补充稀盐酸,发生装置应择 ,收集装置应选择 。
(4)实验室通过加热亚硝酸钠和氯化铵的混合溶液制取并收集N2时,应选择___________与 组合而成的装置。
【答案】(1)集气瓶 (1分)
(2)CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O (2分) 50 (1分)
(3)①A (1分) C (1分) ② C (1分) F (1分)
(4)D (1分) H (1分)
【解析】(1)由图可知,仪器x的名称为集气瓶;
(2)CaCO3和稀盐酸反应的化学方程式为CaCO3+2HCl=CaCl2+ H2O+ CO2↑,设制备22g二氧化碳至少消耗碳酸钙的质量为x,CaCO3+2HCl=CaCl2+ H2O+ CO2↑
100 44
X 22g
100/44=x/22g,解得x=50g
(3)①用大理石和稀盐酸制取CO2属于固液常温型制取气体,可用的发生装置有A C;
②若要制备多瓶CO2,并在制取过程中便于补充稀盐酸,则需要选择反应容器大、带有长颈漏斗的发生装置C,二氧化碳的密度比空气大,可用向上排空法收集,能溶于水,不能用排水法收集,故收集装置选择F;
(4)实验室通过加热亚硝酸钠和氯化铵的混合溶液制取N2,属于液体混合加热型,应选用发生装置D,氮气不溶于水且不与水反应,可采用排水法收集,氮气的相对分子质量是28,空气的平均相对分子质量是29,所以氮气密度与空气密度很接近,若用向下排空法收集,无法彻底排空空气,故收集装置选择H。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】分析下表数据,与深冷法相比,变压吸附法的优点是 。
项目 | 变压吸附法 | 深冷法 |
最大产量(m3/h) | 3200 | 20000 |
产品气含氧量(%) | 93~95 | 99.5~99.8 |
工作表压强(kPa) | -70~40 | 460~750 |
温度(℃) | 0~40 | -109~-190 |
产每立方米氧气耗电量(kW·h) | 0.40 | 0.50~0.65 |