题目内容
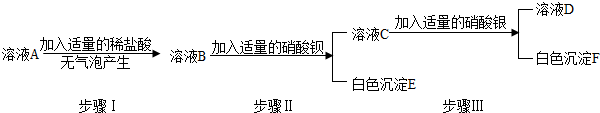
 某溶液可能由硝酸、氯化钠、硫酸钠、氯化铜溶液中的一种或几种混合而成.为探究其组成,小明进行了如下实验:
某溶液可能由硝酸、氯化钠、硫酸钠、氯化铜溶液中的一种或几种混合而成.为探究其组成,小明进行了如下实验:Ⅰ.观察溶液颜色,溶液呈蓝色.
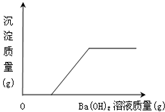
Ⅱ.取一定量该溶液,向其中滴加Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液质量的关系如图所示.
(1)由此可推断该溶液中一定含有
CuCl2和HNO3
CuCl2和HNO3
(写化学式,下同),一定不含有Na2SO4
Na2SO4
,生成的沉淀物是Cu(OH)2
Cu(OH)2
.(2)为了进一步探究该溶液中可能含有的物质是否存在,小明设计了如下实验方案:取原溶液少许,向其中加入适量硝酸银溶液,若产生白色沉淀,则证明该物质存在;若无沉淀生成,则证明该物质不存在.你认为此实验方案是否合理?
不合理
不合理
(填“合理”或“不合理”)你的理由是氯化铜中也含有氯离子,与硝酸银产生白色沉淀
氯化铜中也含有氯离子,与硝酸银产生白色沉淀
.分析:要根据每一步操作的现象和说明的问题来判断样品的组成,还要知道不溶于硝酸的白色沉淀有硫酸钡和氯化银.根据图中可以看出,起始阶段没有沉淀产生沉淀,所以混合物中不含有硫酸根离子,由于消耗了氢氧化钡,所以一定存在硝酸.由于硝酸和氢氧化钡反应逐渐消耗,直至硝酸被完全消耗,才产生沉淀,所以该沉淀一定不是硫酸钡.由于加入的是氢氧化钡,所以对应的沉淀应该是与氢氧根离子有关,所以生成的沉淀物为氢氧化铜沉淀.所以原混合物应该为硝酸和氯化铜的混合物.
解答:解:(1)观察溶液呈蓝色,说明一定含有带铜离子的氯化铜;读图可知沉淀开始时没有产生,说明原溶液中有显酸性的硝酸,硫酸钠与氢氧化钡反应生成硫酸钡白色沉淀,因为硫酸钡不溶于三大强酸,因此没有硫酸钠;因为氯化钠的存在与否不影响整个的实验现象,所以可能存在;氯化铜与氢氧化钡能产生的沉淀是氢氧化铜蓝色沉淀;
故答案为:CuCl2和HNO3; Na2SO4; Cu(OH)2.
(2)验证可能存在的氯化钠要用硝酸银溶液与其中的氯离子产生不溶于稀硝酸的白色沉淀,但一定存在的氯化铜溶液中也含有氯离子与硝酸银溶液产生一样的现象,故无法确定氯化钠的存在.
故答案为:不合理 氯化铜中也含有氯离子,与硝酸银产生白色沉淀.
故答案为:CuCl2和HNO3; Na2SO4; Cu(OH)2.
(2)验证可能存在的氯化钠要用硝酸银溶液与其中的氯离子产生不溶于稀硝酸的白色沉淀,但一定存在的氯化铜溶液中也含有氯离子与硝酸银溶液产生一样的现象,故无法确定氯化钠的存在.
故答案为:不合理 氯化铜中也含有氯离子,与硝酸银产生白色沉淀.
点评:鉴别题关键要抓住信息,利用物质的性质由现象得出正确结论,图表分析时一定要注意从图中归纳出信息提示,如本题中加入氢氧化钡,却在开始阶段没有沉淀,所以硫酸根离子不存在,而同时消耗了氢氧化钡,所以该混合物一定能够消耗氢氧根离子,所以混合物为酸性的溶液.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
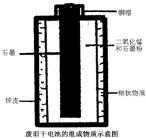 (2007?青岛)下面是某化学兴趣小组探究废旧干电池中白色糊状物成分的过程,
(2007?青岛)下面是某化学兴趣小组探究废旧干电池中白色糊状物成分的过程,