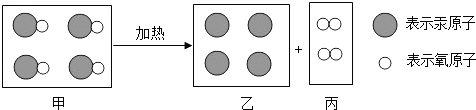
��Ŀ����
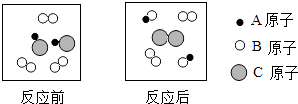
����Ŀ����������ͷ�Ĵ����к����������Ȼ��ƣ�Ϊ�ⶨ�ô�����̼���Ƶ�����������ȡ����Ʒ11g��ȫ����Һ��100gˮ�У����μ��Ȼ�����Һ����Ӧ�������ͼ��ʾ��A��ʱ�����ˣ��õ���Һ242g������Ӧ����ʽ��Na2CO3+CaCl2�TCaCO3��+2NaCl�����㣺 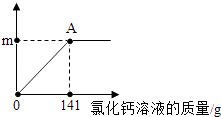
��1����Ӧ���ɳ���������mΪ���٣�
��2����Ʒ��̼���Ƶ�����������
��3����Һ�����ʵ�����������
���𰸡�
��1���⣺��Ӧ���ɳ���������mΪ����11g+100g+141g����242g=10g��
�𣺷�Ӧ���ɳ���������mΪ10g
��2���⣺����Ʒ��̼���Ƶ�����Ϊx����Ӧ���ɵ��Ȼ�������Ϊy
Na2CO3+CaCl2�T | CaCO3��+ | 2NaCl |
106 | 100 | 117 |
x | 10g | y |
![]()
��ã�x=10.6g��y=11.7g
��Ʒ��̼���Ƶ���������Ϊ ![]() ��100%=96.4%��
��100%=96.4%��
����Ʒ��̼���Ƶ���������Ϊ96.4%
��3���⣺��Һ�����ʵ���������Ϊ�� ![]() ��100%=5%��
��100%=5%��
����Һ�����ʵ���������Ϊ5%
��������̼���ƺ��Ȼ��Ʒ�Ӧ���ɰ�ɫ����̼��ƺ��Ȼ��ƣ���Ӧǰ��������Ϊ��Ӧ����̼��Ƶ��������ٸ��ݷ�Ӧ�Ļ�ѧ����ʽ���ṩ�����ݿ��Խ�����ط���ļ��㣮
�����㾫����������Ĺؼ�����������ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ�����ո����ʼ�������=ϵ������Է�������֮�ȣ�