题目内容
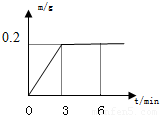
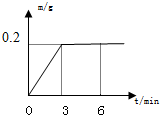
将不纯的锌8g(杂质不与硫酸发生反应)与足量的稀硫酸反应时,发出氢气的质量(m)随时间(t)的变化曲线如图所示.(已知:Zn+H2SO4=ZnSO4+H2↑)(1)第______min时,锌粒与稀硫酸完全反应,发出氢气的质量为______g.
(2)求不纯锌粒中锌的质量分数是多少?
【答案】分析:分析图象,转折点表示锌与硫酸恰好完全反应时的时间与产生氢气的质量,根据氢气的质量可求出参加反应的锌的质量,从而求出质量分数.
解答:解:(1)由图象可知3min时,氢气质量不再增加,说明锌与稀硫酸完全反应,此时产生氢气0.2g
(2)设不纯锌粒中锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2g
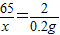
x=6.5g
不纯锌粒中锌的质量分数是 =81.25%
=81.25%
答:不纯锌粒中锌的质量分数为81.25%
故答案为:(1)3 0.2 (2)81.25%
点评:本题考查图象与化学方程式相结合的计算,关键分析图象中数据.
解答:解:(1)由图象可知3min时,氢气质量不再增加,说明锌与稀硫酸完全反应,此时产生氢气0.2g
(2)设不纯锌粒中锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2g
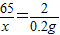
x=6.5g
不纯锌粒中锌的质量分数是
 =81.25%
=81.25%答:不纯锌粒中锌的质量分数为81.25%
故答案为:(1)3 0.2 (2)81.25%
点评:本题考查图象与化学方程式相结合的计算,关键分析图象中数据.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
 将不纯的锌8g(杂质不与硫酸发生反应)与足量的稀硫酸反应时,发出氢气的质量(m)随时间(t)的变化曲线如图所示.(已知:Zn+H2SO4=ZnSO4+H2↑)
将不纯的锌8g(杂质不与硫酸发生反应)与足量的稀硫酸反应时,发出氢气的质量(m)随时间(t)的变化曲线如图所示.(已知:Zn+H2SO4=ZnSO4+H2↑)