题目内容
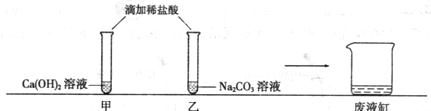
甲、乙同学在学完酸的化学性质后,做了如下实验:

实验结束后,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论.
【观察讨论1】甲同学在做实验时没有观察到明显现象,于是对氢氧化钙溶液和稀盐酸能发生反应表示怀疑.但乙同学认为,甲同学实验时向氢氧化钙溶液中应先滴几滴
【观察讨论2】当乙同学沿废液缸内壁缓慢倾倒液体时,观察到废液缸中先有气泡产生,然后又出现了白色沉淀.经过讨论确定,甲、乙同学试管中废液含有的溶质分别是
为了科学处理试验后产生的废液,甲、乙同学决定对废液缸中最终废液溶质的成分进行探究.
【提出问题】最终废液中含有什么溶质?
【猜想假设】甲同学猜想:废液中含有NaCl、CaCl2两种物质乙同学猜想:废液中含有NaCl、Na2CO3两种物质
【活动探究】甲、乙同学为了验证自己的猜想分别同时进行了如下实验:甲同学实验:取少量废液于试管中,向其中滴加碳酸钠溶液,无明显现象.得出结论:甲猜想不成立,则乙猜想成立.
【反思评价】请对甲同学由实验现象得出的结论给予评价
【运用】乙同学为了验证他的结论是正确的,所做的实验操作是

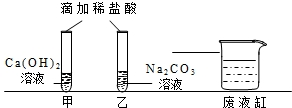
实验结束后,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论.
【观察讨论1】甲同学在做实验时没有观察到明显现象,于是对氢氧化钙溶液和稀盐酸能发生反应表示怀疑.但乙同学认为,甲同学实验时向氢氧化钙溶液中应先滴几滴
酚酞
酚酞
酚酞
酚酞
试液,再滴加适量的稀盐酸,当观察到酚酞试液由红色变无色(或酚酞试液红色褪去)
酚酞试液由红色变无色(或酚酞试液红色褪去)
时.就可以说明两种物质能发生反应.【观察讨论2】当乙同学沿废液缸内壁缓慢倾倒液体时,观察到废液缸中先有气泡产生,然后又出现了白色沉淀.经过讨论确定,甲、乙同学试管中废液含有的溶质分别是
CaCl2、HCl
CaCl2、HCl
、NaCl、Na2CO3
NaCl、Na2CO3
(均写化学式),才会出现上述现象.为了科学处理试验后产生的废液,甲、乙同学决定对废液缸中最终废液溶质的成分进行探究.
【提出问题】最终废液中含有什么溶质?
【猜想假设】甲同学猜想:废液中含有NaCl、CaCl2两种物质乙同学猜想:废液中含有NaCl、Na2CO3两种物质
【活动探究】甲、乙同学为了验证自己的猜想分别同时进行了如下实验:甲同学实验:取少量废液于试管中,向其中滴加碳酸钠溶液,无明显现象.得出结论:甲猜想不成立,则乙猜想成立.
【反思评价】请对甲同学由实验现象得出的结论给予评价
不能确定是否含有氯化钙
不能确定是否含有氯化钙
.【运用】乙同学为了验证他的结论是正确的,所做的实验操作是
取少量废液于试管中,向其中滴加适量的CaCl2溶液 产生白色沉淀
取少量废液于试管中,向其中滴加适量的CaCl2溶液 产生白色沉淀
.分析:【观察与讨论1】氢氧化钙溶液呈碱性,可以使酚酞变红,可以利用该性质来解答该题;
【观察与讨论2】废液缸中先有气泡产生,然后又出现了白色沉淀,能够产生气体的是碳酸根和酸,能够生成沉淀的是碳酸根和钙离子,可以据此完成的解答;
【反思评价】要证明甲同学的猜想,可以从氯化钙着手,加入碳酸钠溶液看是否产生白色沉淀但盐酸能和碳酸钠反应产生气泡;
【运用】要证明乙的猜想,可以从碳酸钠着手,加入氯化钙溶液看是否产生白色沉淀.
【观察与讨论2】废液缸中先有气泡产生,然后又出现了白色沉淀,能够产生气体的是碳酸根和酸,能够生成沉淀的是碳酸根和钙离子,可以据此完成的解答;
【反思评价】要证明甲同学的猜想,可以从氯化钙着手,加入碳酸钠溶液看是否产生白色沉淀但盐酸能和碳酸钠反应产生气泡;
【运用】要证明乙的猜想,可以从碳酸钠着手,加入氯化钙溶液看是否产生白色沉淀.
解答:解:【观察与讨论1】酚酞溶液遇碱性溶液会变红;而在中性或酸性溶液中无色,所以可以用酚酞溶液来判断碱是否被中和;
【观察与讨论2】废液缸中先有气泡产生,然后又出现了白色沉淀,结合图中所给的甲和乙的药品可以知道,甲中盐酸和氢氧化钙溶液生成氯化钙和水,乙中盐酸和碳酸钠生成氯化钠和水和二氧化碳,而一开始没有沉淀但是有气体产生,说明甲中所加入的盐酸是过量的,而乙中的碳酸钠没有被完全消耗掉,故可以判断甲中含有的溶质为氯化钙和盐酸,而废液中含有的溶质为碳酸钠和氯化钠;
【反思评价】要证明甲同学的猜想,可以从氯化钙着手,加入碳酸钠溶液看是否产生白色沉淀但若滴加的盐酸过量的话滴入碳酸钠因为盐酸能和碳酸钠反应所以也不会产生沉淀,但会有气泡产生,实验中无明显现象所以可以验证甲的猜想正确;
【运用】取少量废液于试管中,向其中滴加适量的CaCl2溶液 产生白色沉淀.
故答案为:【观察与讨论1】酚酞;酚酞试液由红色变无色(或酚酞试液红色褪去);
【观察与讨论2】CaCl2、HCl;NaCl、Na2CO3.
【反思评价】能确定是否含有氯化钙;取少量废液于试管中,向其中滴加适量的CaCl2溶液 产生白色沉淀
【观察与讨论2】废液缸中先有气泡产生,然后又出现了白色沉淀,结合图中所给的甲和乙的药品可以知道,甲中盐酸和氢氧化钙溶液生成氯化钙和水,乙中盐酸和碳酸钠生成氯化钠和水和二氧化碳,而一开始没有沉淀但是有气体产生,说明甲中所加入的盐酸是过量的,而乙中的碳酸钠没有被完全消耗掉,故可以判断甲中含有的溶质为氯化钙和盐酸,而废液中含有的溶质为碳酸钠和氯化钠;
【反思评价】要证明甲同学的猜想,可以从氯化钙着手,加入碳酸钠溶液看是否产生白色沉淀但若滴加的盐酸过量的话滴入碳酸钠因为盐酸能和碳酸钠反应所以也不会产生沉淀,但会有气泡产生,实验中无明显现象所以可以验证甲的猜想正确;
【运用】取少量废液于试管中,向其中滴加适量的CaCl2溶液 产生白色沉淀.
故答案为:【观察与讨论1】酚酞;酚酞试液由红色变无色(或酚酞试液红色褪去);
【观察与讨论2】CaCl2、HCl;NaCl、Na2CO3.
【反思评价】能确定是否含有氯化钙;取少量废液于试管中,向其中滴加适量的CaCl2溶液 产生白色沉淀
点评:本题主要考查化学实验方案的设计与评价,根据物质的性质和物质间的反应规律,学会运用猜想与事实验证的方法和技巧处理实验问题.解答此题的关键是只需要对所涉及的各个反应中反应物是否恰好完全反应做出假设,若反应物恰好完全反应,则废液中的溶质只有生成物,若反应结束后反应物仍有剩余,则废液中的溶质除了生成物外还有剩余的反应物.熟练掌握盐酸、碳酸钠和氯化钙的化学性质,知道在酸性的环境下碳酸钙难以以沉淀的形式析出.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目