题目内容
【题目】为测定某石灰石的纯度(石灰石中所含杂质不与盐酸反应,不溶于盐酸也不溶于水),某同学实验并记录如下:
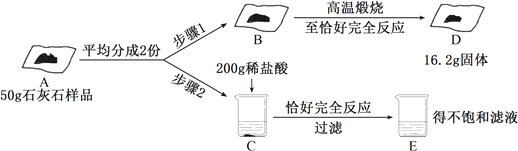
(1)写出高温煅烧石灰石所发生反应的化学方程式__________________________________________;(2)根据已知条件列出求解B中参加反应的碳酸钙质量(x)的比例式______________________;
(3)此石灰石的纯度为___________;
(4)配制上述实验所用的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是_________;
(5)向E烧杯内加入232.8克的水,得到的溶质的质量分数为_____________。
【答案】 CaCO3![]() CaO+CO2↑ 100:44=X:8.8g 80% 40g 5%
CaO+CO2↑ 100:44=X:8.8g 80% 40g 5%
【解析】本题考查了根据化学方程式进行计算,根据流程提供的化学反应和数据进行分析。
(1)煅烧石灰石生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3高温CaO+CO2↑;
(2)设:参加反应的碳酸钙质量为x
生成的二氧化碳的质量=25g-16.2g=8.8g
CaCO3高温CaO+CO2
100 44
X 8.8g
所以B中参加反应的碳酸钙质量(x)的比例式为:100:44=X:8.8g;
解之得x=20g
(3)石灰石的纯度=![]() ×100%=80%
×100%=80%
(4)设:需要质量分数为36.5%的浓盐酸的质量为y,同时生成氯化钙的质量为z,二氧化碳的质量为a。
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 73 111 44
20g y× 36.5% z a
![]() =
=![]() y=40g
y=40g
![]() =
=![]() z=22.2g
z=22.2g
![]() =
=![]() a=8.8g
a=8.8g
(5)向E烧杯内加入232.8克的水,得到的溶质的质量分数=![]() ×100%=5%
×100%=5%

练习册系列答案
相关题目