题目内容
小亮对铁丝在氧气里燃烧时出现的红热球状物产生了兴趣,随后他进行了以下探究活动.
问题1:铁燃烧后剩下来的球状物质中还有没有铁呢?
实验探究:将剩下来的球状物质碾碎,加入
问题2:铁燃烧的产物为什么不是Fe2O3呢?
查阅资料:
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
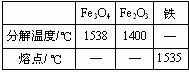
(2)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
(3)Fe2O3高温时分解成Fe3O4
理论探讨:实验测定铁在氧气里燃烧的产物是Fe3O4,结合表中数据,可推知铁在氧气里燃烧时产生的高温应在
拓展延伸:
(1)实验中为了防止集气瓶炸裂,必须
(2)有些食品包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色
问题1:铁燃烧后剩下来的球状物质中还有没有铁呢?
实验探究:将剩下来的球状物质碾碎,加入
稀盐酸(稀硫酸)
稀盐酸(稀硫酸)
溶液,观察到的现象是生成气体
生成气体
,说明铁燃烧时溅落下来的黑色物质中还含有铁.
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | |
| 熔点/℃ | 1535 |
查阅资料:
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
(3)Fe2O3高温时分解成Fe3O4
理论探讨:实验测定铁在氧气里燃烧的产物是Fe3O4,结合表中数据,可推知铁在氧气里燃烧时产生的高温应在
1535--1538
1535--1538
℃之间,在此温度范围内Fe2O3
Fe2O3
已分解.拓展延伸:
(1)实验中为了防止集气瓶炸裂,必须
在瓶底留有少量水或者沙子
在瓶底留有少量水或者沙子
;(2)有些食品包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色
变红
变红
,就说明包装盒破损进气,这样售货员就能及时发现并处理.分析:根据铁能与酸反应生成氢气考虑;由于铁丝燃烧时先由于温度升高开始熔化后达到着火点燃烧考虑,再根据氧化铁的熔点考虑;(1)根据防止铁丝燃烧产生的产物溅落到集气瓶底部使集气瓶炸裂考虑;(2)根据FeO极易被氧化考虑.
解答:解:铁能与酸反应生成氢气,所以如果将剩下来的球状物质碾碎,加入稀盐酸或稀硫酸,如果有气泡产生,说明含有铁;由于铁丝燃烧时先由于温度升高开始熔化后达到着火点燃烧,所以温度需要达到铁的熔点,又因为生成物是四氧化三铁,所以温度不能高于四氧化三铁的分解温度,否则会得不到四氧化三铁,所以温度是1535--1538之间;由于在该温度下氧化铁已经分解,所以得不到氧化铁;
(1)由于铁丝燃烧产生的产物溅落到集气瓶底部使集气瓶炸裂,所以在铁丝燃烧的集气瓶底部放少量的水或铺一层细沙,防止集气瓶炸裂;
(2)FeO极易被氧化为Fe2O3,因为氧化铁是红色固体,所以现象是变为红色.
故答案为:稀盐酸(稀硫酸);生成气体[或者:硫酸铜,生成红色固体];【理论探讨】1535--1538;Fe2O3;【拓展延伸】(1)在瓶底留有少量水或者沙子;(2)变红.
(1)由于铁丝燃烧产生的产物溅落到集气瓶底部使集气瓶炸裂,所以在铁丝燃烧的集气瓶底部放少量的水或铺一层细沙,防止集气瓶炸裂;
(2)FeO极易被氧化为Fe2O3,因为氧化铁是红色固体,所以现象是变为红色.
故答案为:稀盐酸(稀硫酸);生成气体[或者:硫酸铜,生成红色固体];【理论探讨】1535--1538;Fe2O3;【拓展延伸】(1)在瓶底留有少量水或者沙子;(2)变红.
点评:解答本题容易出错的地方是铁丝燃烧的温度范围,要知道铁丝燃烧需要达到熔点才能开始燃烧,温度不能超过四氧化三铁的分解温度,否则就得不到四氧化三铁了.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目