题目内容
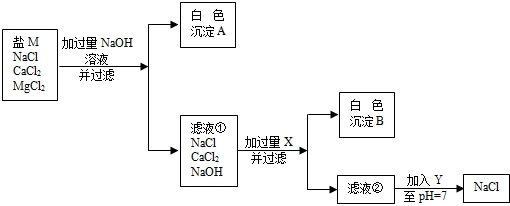
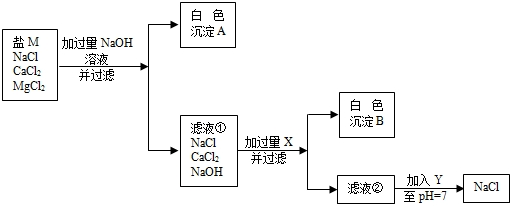
24、粗盐经溶解、过滤将不溶杂质除去,得到较纯的盐M.盐M中仍含有少量的可溶性杂质氯化钙和氯化镁.为除去盐M中含有的氯化钙和氯化镁,某同学设计了如下实验进行探究: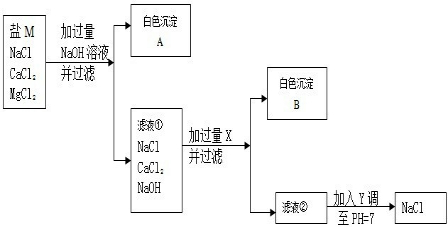
物质的溶解性,可查阅第20题中“部分酸、碱、盐的溶解性表(20℃)”(本题将“微溶”当成“可溶”),观察上图后回答以下问题
(1)加入过量的NaOH的目的是
(2)滤液②中的溶质是
(3)生成白色沉淀B的化学方程式是

物质的溶解性,可查阅第20题中“部分酸、碱、盐的溶解性表(20℃)”(本题将“微溶”当成“可溶”),观察上图后回答以下问题
(1)加入过量的NaOH的目的是
除去Mg2+
,Y是HCl
(填化学式)(2)滤液②中的溶质是
NaOH、NaCl、Na2CO3
.(填化学式)(3)生成白色沉淀B的化学方程式是
Na2CO3+CaCl2═CaCO3↓+2NaCl
.滤液②加入调至PH=7时的化学反应方程式是HCl+NaOH═NaCl+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑
.分析:(1)根据氢氧根离子会与镁离子生成沉淀进行分析;
根据反应剩余的氢氧化钠和碳酸钠对于氯化钠也是杂质进行分析;
(2)根据加入的X、Y和除杂时的反应原理进行分析;
(3)根据碳酸根离子会与钙离子生成沉淀进行分析;
根据(2)中推出的滤液②中的溶质进行分析.
根据反应剩余的氢氧化钠和碳酸钠对于氯化钠也是杂质进行分析;
(2)根据加入的X、Y和除杂时的反应原理进行分析;
(3)根据碳酸根离子会与钙离子生成沉淀进行分析;
根据(2)中推出的滤液②中的溶质进行分析.
解答:解:(1)钠离子形成的化合物都溶于水,氢氧根离子会与镁离子生成氢氧化镁沉淀,在除去镁离子和钙离子时,加入的氢氧化钠和碳酸钠都是过量的,对于氯化钠也是杂质,需要将两者转化为氯化钠,故答案为:除去Mg2+,HCl;
(2)加入过量的氢氧化钠反应后生成氢氧化镁沉淀和氯化钠,加入过量的碳酸钠后生成碳酸钙沉淀和氯化钠,过滤后溶液中就剩下氯化钠、氢氧化钠、和碳酸钠,
故答案为:NaOH、NaCl、Na2CO3;
(3)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,故答案为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
盐酸和氢氧化钠反应生成氯化钠和水,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,故答案为:HCl+NaOH═NaCl+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)加入过量的氢氧化钠反应后生成氢氧化镁沉淀和氯化钠,加入过量的碳酸钠后生成碳酸钙沉淀和氯化钠,过滤后溶液中就剩下氯化钠、氢氧化钠、和碳酸钠,
故答案为:NaOH、NaCl、Na2CO3;
(3)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,故答案为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
盐酸和氢氧化钠反应生成氯化钠和水,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,故答案为:HCl+NaOH═NaCl+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑;
点评:在解此类题时,首先分析各步中加入试剂的作用,然后结合题中的问题和除杂的原则进行分析解答.

练习册系列答案
相关题目