题目内容
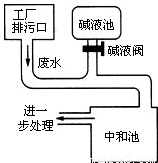
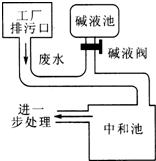 24、如图为硫酸厂废水处理示意图,排污口流出的废水用碱液池流出的碱中和.工业生产中,在测定废水(假设只含硫酸)中硫酸的质量分数的基础上,通过调节碱液阀控制碱液的流量(单位时间排出碱液的量)达到中和废水的目的.
24、如图为硫酸厂废水处理示意图,排污口流出的废水用碱液池流出的碱中和.工业生产中,在测定废水(假设只含硫酸)中硫酸的质量分数的基础上,通过调节碱液阀控制碱液的流量(单位时间排出碱液的量)达到中和废水的目的.(1)已知:中和50 mL废水需要l%NaOH溶液40 mL.试求:废水中硫酸的质量分数.(假设废水和NaOH溶液的密度均为1 g?cm-3)
(2)用1%的KOH溶液替代l%的NaOH溶液,不仅可以中和废水、又可得到钾肥(K2SO4).若保持废水的流量不变并被完全中和,则KOH溶液的流量应该
大于
(填“大于”或“小于”)NaOH溶液的流量.分析:(1)根据氢氧化钠与硫酸反应的化学方程式和已知条件,列出比例式,即可计算出废水中硫酸的质量分数;
(2)根据氢氧化钠与氢氧化钾的化学式,即可计算出它们的相对分子质量,然后进行比较,即可正确答题.
(2)根据氢氧化钠与氢氧化钾的化学式,即可计算出它们的相对分子质量,然后进行比较,即可正确答题.
解答:解:(1)解:设废水中硫酸的质量分数为x,
2NaOH+H2SO4═Na2SO4+2H2O
80:98
40mL×1g?cm-3×1%,50mL×1g?cm-3×x
∴80:98=(40mL×1g?cm-3×1%):(50mL×1g?cm-3×x),
解之得:x=0.98%.
答:废水中硫酸的质量分数是0.98%.
(2)根据KOH与硫酸反应的化学方程式可得,
2KOH+H2SO4═K2SO4+2H2O
112-----98
由化学方程式可以看出,KOH的相对分子质量>NaOH的相对分子质量,故要中和废水,则KOH溶液的流量应该大于NaOH溶液的流量.
故答案为:大于.
2NaOH+H2SO4═Na2SO4+2H2O
80:98
40mL×1g?cm-3×1%,50mL×1g?cm-3×x
∴80:98=(40mL×1g?cm-3×1%):(50mL×1g?cm-3×x),
解之得:x=0.98%.
答:废水中硫酸的质量分数是0.98%.
(2)根据KOH与硫酸反应的化学方程式可得,
2KOH+H2SO4═K2SO4+2H2O
112-----98
由化学方程式可以看出,KOH的相对分子质量>NaOH的相对分子质量,故要中和废水,则KOH溶液的流量应该大于NaOH溶液的流量.
故答案为:大于.
点评:本题主要考查学生运用化学方程式进行计算的能力.

练习册系列答案
相关题目
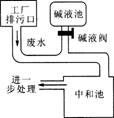
 如图为硫酸厂废水处理示意图,排污口流出的废水用碱液池流出的碱中和.工业生产中,在测定废水(假设只含硫酸)中硫酸的质量分数的基础上,通过调节碱液阀控制碱液的流量(单位时间排出碱液的量)达到中和废水的目的.
如图为硫酸厂废水处理示意图,排污口流出的废水用碱液池流出的碱中和.工业生产中,在测定废水(假设只含硫酸)中硫酸的质量分数的基础上,通过调节碱液阀控制碱液的流量(单位时间排出碱液的量)达到中和废水的目的.