题目内容
【题目】向160g硫酸铜溶液中,逐滴加入40g NaOH溶液,恰好完全反应,生成4.9g沉淀,回答下列问题: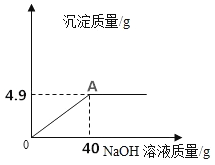
(1)恰好完全反应后,溶液的质量为g.
(2)将反应结束后的混合物过滤,滤液中溶质是(填化学式).
(3)求原硫酸铜溶液中溶质的质量分数(写出计算过程)
【答案】
(1)195.1
(2)Na2SO4
(3)
设参加反应的硫酸铜的质量为x
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,
160 98
x 4.9g
![]()
x=8g
所以原硫酸铜溶液中溶质的质量分数为: ![]() ×100%=5%.
×100%=5%.
【解析】(1)恰好完全反应后,溶液的质量为:160g+40g﹣4.9g=195.1g;
(2)A点为硫酸铜溶液和NaOH溶液恰好完全反应,故滤液中所含溶质为硫酸钠,化学式为:Na2SO4;
所以答案是:(1)195.1g;(2)Na2SO4;(3)原硫酸铜溶液中溶质的质量分数为5%.
【考点精析】本题主要考查了质量守恒定律及其应用和根据化学反应方程式的计算的相关知识点,需要掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏;各物质间质量比=系数×相对分子质量之比才能正确解答此题.

练习册系列答案
相关题目