题目内容
 向纯碱的水溶液中滴入酚酞试液,试液变
向纯碱的水溶液中滴入酚酞试液,试液变我国科学家侯德榜创造了一种著名的纯碱生产方法--“联合制碱法”.
(1)“联合制碱法”生产过程用化学方程式可简要表示为:
①NH3+CO2+H2O═NH4HCO3 ②NH4HCO3+NaCl═NaHCO3↓+NH4Cl ③2NaHCO3═Na2CO3+H2O+CO2↑
该过程中没有涉及到的基本反应类型是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(2)第②步中加入的是磨细食盐粉.食盐磨细的目的是:
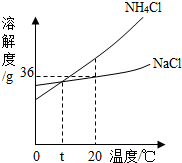
(3)将第②步所得滤液(NH4Cl与剩余NaCl的混合溶液)降温,NH4Cl晶体大量析出,而NaCl却仍留在了溶液中.你认为NH4Cl先结晶的原因可能是什么:
答:
分析:根据碳酸钠溶液呈碱性判断酚酞试液变色情况和其pH大小
(1)根据四种基本反应类型的定义和特点回答;
(2)根据磨细食盐粉的表面积增大分析回答;
(3)根据氯化钠和氯化铵的溶解度受温度影响的情况回答.
(1)根据四种基本反应类型的定义和特点回答;
(2)根据磨细食盐粉的表面积增大分析回答;
(3)根据氯化钠和氯化铵的溶解度受温度影响的情况回答.
解答:解:碳酸钠是由钠离子和碳酸根离子构成的,属于盐类,其水溶液呈碱性,溶液的pH大于7,能使无色的酚酞溶液变红色,故填:红,>;
(1)①NH3+CO2+H2O=NH4HCO3 的特点是“多变一”,符合化合反应的定义和特点,为化合反应;②NH4HCO3+NaCl=NaHCO3↓+NH4Cl的特点是“两交换,价不变”,符合复分解反应的定义和特点,为复分解反应;③2NaHCO3
Na2CO3+H2O+CO2↑的特点是“一变多”,符合分解反应的定义和特点,为化合反应.缺少的基本反应类型是置换反应;
(3)磨细食盐粉的表面积增大,加快食盐溶解,增大食盐和碳酸氢铵的接触面积,进而加快反应速率;
(4)NH4Cl溶解度受温度影响较大,且随温度降低而明显减小,而NaCl溶解度受温度影响不大,所以降温后NH4Cl晶体大量析出,而NaCl却仍留在了溶液中.
故答案为:红,>;(1)C;(2)增大接触面积,使反应充分进行;(3)NH4Cl溶解度受温度影响较大.
(1)①NH3+CO2+H2O=NH4HCO3 的特点是“多变一”,符合化合反应的定义和特点,为化合反应;②NH4HCO3+NaCl=NaHCO3↓+NH4Cl的特点是“两交换,价不变”,符合复分解反应的定义和特点,为复分解反应;③2NaHCO3
| ||
(3)磨细食盐粉的表面积增大,加快食盐溶解,增大食盐和碳酸氢铵的接触面积,进而加快反应速率;
(4)NH4Cl溶解度受温度影响较大,且随温度降低而明显减小,而NaCl溶解度受温度影响不大,所以降温后NH4Cl晶体大量析出,而NaCl却仍留在了溶液中.
故答案为:红,>;(1)C;(2)增大接触面积,使反应充分进行;(3)NH4Cl溶解度受温度影响较大.
点评:化学来源于生产、生活,又服务于生产、生活.氨碱工业是初中化学重要的应用之一,是考查重点,常涉及化学方程式的书写,反应时析出碳酸氢钠的原因与物质溶解度的关系等重点内容.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
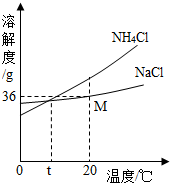 我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答:
我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答: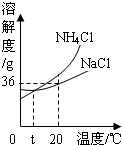
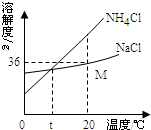 我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答:
我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答: