题目内容
根据如图所示有关物质性质的实验,回答以下问题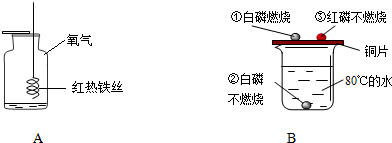
(1)装置A中的现象:铁丝在氧气中剧烈燃烧, ,放出大量的热,生成黑色固体,试写出化学方程式 .
(2)装置B中,对比现象①②说明物质燃烧需要 ;对比现象①③说明两种可燃物的 不同.

(1)装置A中的现象:铁丝在氧气中剧烈燃烧,
(2)装置B中,对比现象①②说明物质燃烧需要
考点:氧气的化学性质,书写化学方程式、文字表达式、电离方程式,燃烧与燃烧的条件
专题:实验性简答题
分析:(1)根据细铁丝在氧气中燃烧的现象和发生的反应分析回答;
(2)该图所示的实验为燃烧条件的探究实验,放置于铜片上的白磷燃烧,而水中白磷、铜片上的红磷均不能燃烧,通过现象的对比与分析,可得出燃烧需要与氧气接触、温度达到可燃物的着火点.
(2)该图所示的实验为燃烧条件的探究实验,放置于铜片上的白磷燃烧,而水中白磷、铜片上的红磷均不能燃烧,通过现象的对比与分析,可得出燃烧需要与氧气接触、温度达到可燃物的着火点.
解答:解:(1)铁丝可以在氧气中剧烈燃烧,火星四射,放出大量的热,生成黑色固体,黑色固体为四氧化三铁,反应的化学方程式是:3Fe+2O2
Fe3O4;
(2)②处的白磷的温度也达到了其着火点,但由于处于水中而不能与氧气接触,因此没有燃烧;①②对比,可判断燃烧需要有氧气的支持,没有氧气时即使温度达到可燃物的着火点,可燃物也不能燃烧;所以,对比现象①②说明物质燃烧需要与氧气接触;③处的红磷虽然处于空气中能与氧气接触,但因温度未能达到其着火点,也没有发生燃烧;①③对比,说明燃烧需要温度达到着火点,温度不能达到着火点时,即使与氧气充分接触,可燃物也不能发生燃烧;
故答为:(1)火星四射,3Fe+2O2
Fe3O4;(2)与氧气接触,着火点.
| ||
(2)②处的白磷的温度也达到了其着火点,但由于处于水中而不能与氧气接触,因此没有燃烧;①②对比,可判断燃烧需要有氧气的支持,没有氧气时即使温度达到可燃物的着火点,可燃物也不能燃烧;所以,对比现象①②说明物质燃烧需要与氧气接触;③处的红磷虽然处于空气中能与氧气接触,但因温度未能达到其着火点,也没有发生燃烧;①③对比,说明燃烧需要温度达到着火点,温度不能达到着火点时,即使与氧气充分接触,可燃物也不能发生燃烧;
故答为:(1)火星四射,3Fe+2O2
| ||
点评:燃烧需要同时具有三个条件才能发生:首先要有可燃物,然后还需要与氧气接触、温度达到可燃物的着火点.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
下列各物质都是生活中常见的物质,其中按混合物、化合物、单质顺序排列的是( )
| A、高锰酸钾、二氧化锰、氮气 |
| B、食盐水、干冰、液态氧 |
| C、洁净的空气、氯化钠、水 |
| D、乙醇、过氧化氢、水银 |
关于合金的说法正确的是( )
| A、合金的熔点一般比组成它们的纯金属更高 |
| B、铁锈是一种合金 |
| C、合金中只含有金属元素 |
| D、合金是一种混合物 |
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,从中获取的信息错误的是( )
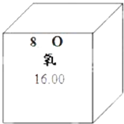

| A、该元素的原子核外有20个电子 |
| B、该元素属于非金属元素 |
| C、该元素的原子序数为20 |
| D、该元素的相对分子质量为40.08 |

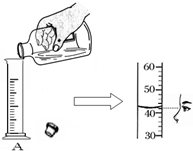 小明同学用100mL的量筒量取一定体积的液体,如图所示:
小明同学用100mL的量筒量取一定体积的液体,如图所示: