题目内容
【题目】现有一包白色固体样品,可能含有BaCl2、Na2SO4、Na2CO3、(NH4)2CO3、KCl、CuSO4中的一种或几种,取样品进行如下实验. 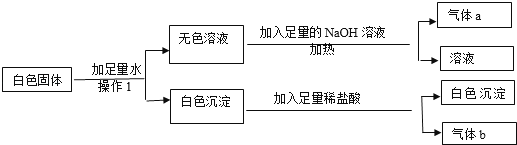
(1)操作1所用到是玻璃仪器有 .
(2)原白色固体中一定不含有 , 一定含有 .
(3)写出生成气体b的化学方程式 .
【答案】
(1)烧杯;漏斗;玻璃棒
(2)CuSO4;BaCl2、Na2SO4、(NH4)2CO3
(3)BaCO3+2HCl=BaCl2+H2O+CO2↑
【解析】解:(1)由题意可知操作1是白色固体加足量水溶解,应用到的玻璃仪器是:烧杯和玻璃棒.(2)由于硫酸铜的溶液显蓝色,根据操作1得到的是无色溶液,说明不含有硫酸铜;由于上述物质的铵根能与氢氧化钠反应放出了氨气,根据无色溶液再加入氢氧化钠加热生成了气体,说明了含有碳酸铵;由于上述物质的氯化钡能与碳酸铵、硫酸钠反应分别生了碳酸钡、硫酸钡沉淀,碳酸钡沉淀能溶于盐酸,硫酸钡不能溶于盐酸,根据操作1可知得到的白色沉淀,能部分溶解于盐酸,说明了含有氯化钡、碳酸铵和硫酸钠,根据上述实验过程不能判断氯化钾、碳酸钠是否存在,故氯化钾、碳酸钠是可能存在的物质.所以,原白色固体中一定不含有CuSO4 , 一定含有BaCl2、Na2SO4、(NH4)2CO3 , 可能含有的物质是Na2CO3、KCl;(3)由上述分析可知,碳酸钡与稀盐酸生成氯化钡、水、二氧化碳,反应的化学方程式:BaCO3+2HCl=BaCl2+H2O+CO2↑.
故答案为:(1)烧杯;漏斗;玻璃棒;(2)CuSO4;BaCl2、Na2SO4、(NH4)2CO3;(3)BaCO3+2HCl=BaCl2+H2O+CO2↑.
(1)根据溶解的操作分析用到的玻璃仪器;(2)根据操作1得到的是无色溶液,说明不含有硫酸铜;根据无色溶液再加入氢氧化钠加热生成了气体,说明了含有碳酸铵;根据操作1可知得到的白色沉淀,能部分溶解于盐酸,说明了含有氯化钡、碳酸铵和硫酸钠,据此分析判断白色固体中的物质;(3)根据碳酸钡与稀盐酸的反应写反应的化学方程式.