题目内容
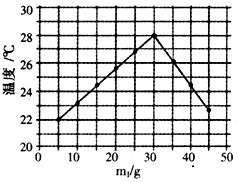 将m1gl0%HCl溶液和m2g未知浓度的NaOH溶液混合均匀并测量记录溶液温度,实验结果如图所示(实验中始终保持m1+m2=50g)下列叙述不正确的是( )
将m1gl0%HCl溶液和m2g未知浓度的NaOH溶液混合均匀并测量记录溶液温度,实验结果如图所示(实验中始终保持m1+m2=50g)下列叙述不正确的是( )分析:A、从图示观察起始温度即为实验时环境温度;
B、根据图示所测溶液温度变化进行分析;
C、根据氢氧化钠溶液与盐酸溶液反应方程式进行计算;
D、根据一个反应无法得出此结论.
B、根据图示所测溶液温度变化进行分析;
C、根据氢氧化钠溶液与盐酸溶液反应方程式进行计算;
D、根据一个反应无法得出此结论.
解答:解:A、该实验开始时温度是22℃,所以实验时环境温度为22℃,故不符合题意;
B、酸与碱的反应为中和反应,中和反应的实质是溶液中OH-和H+结合生成H2O分子,故不符合题意;
C、恰好反应时参加反应的盐酸溶液的质量是30g,由m1+m2=50g可知,消耗的氢氧化钠溶液的质量为20g.
设恰好反应时氢氧化钠溶液中溶质的质量是X.
HCl+NaOH=NaCl+H 2O
36.5 40
30g×10% X
=
X≈3.3g
氢氧化钠溶液溶质的质量分数=
×100%=16.5%
所以该选项错误,符合题意.
D、由图示可以看出m1从5g-30g,溶液的温度始终在升高,然后逐渐下降,说明30g时二者恰好反应,该反应过程放出热量,故说法正确,所以不符合题意.
故选C.
B、酸与碱的反应为中和反应,中和反应的实质是溶液中OH-和H+结合生成H2O分子,故不符合题意;
C、恰好反应时参加反应的盐酸溶液的质量是30g,由m1+m2=50g可知,消耗的氢氧化钠溶液的质量为20g.
设恰好反应时氢氧化钠溶液中溶质的质量是X.
HCl+NaOH=NaCl+H 2O
36.5 40
30g×10% X
| 36.5 |
| 40 |
| 30g×10% |
| X |
X≈3.3g
氢氧化钠溶液溶质的质量分数=
| 3.3g |
| 20g |
所以该选项错误,符合题意.
D、由图示可以看出m1从5g-30g,溶液的温度始终在升高,然后逐渐下降,说明30g时二者恰好反应,该反应过程放出热量,故说法正确,所以不符合题意.
故选C.
点评:本题结合中和反应考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,比较综合,要认真分析解答.

练习册系列答案
相关题目



