题目内容
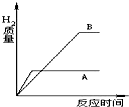 等质量的A、B两种活泼金属(化合价均为+2价),与足量稀盐酸反应时,产生H2的质量与反应时间的函数关系如图所示.试比较:
等质量的A、B两种活泼金属(化合价均为+2价),与足量稀盐酸反应时,产生H2的质量与反应时间的函数关系如图所示.试比较:(1)金属的活动性较强的是
(2)产生氢气较少的金属是
(3)A、B两种金属可能分别是
a.镁和铁 b.锌和铁 c.锌和铜.
考点:金属的化学性质
专题:金属与金属材料
分析:根据已有的知识进行分析,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,金属的位置越靠前,与酸反应生成氢气的速率越大,在坐标中的斜线越陡,金属与酸反应当金属在生成物中的化合价相同时通常金属的相对原子质量越大,产生的氢气越少.
解答:解:(1)金属的位置越靠前,与酸反应生成氢气的速率越大,在坐标中的斜线越陡,据图可以看出,A的斜线比B陡,故A的活动性强于B,故填:A;
(2)据图可以看出A产生的氢气少,B产生的氢气多,故填:A;
(3)金属与足量的酸反应时,当金属在生成物中的化合价相同时通常金属的相对原子质量越大,产生的氢气越少,由图象,观察反应速度A快和生成气体B多进行判断A比B活泼,A的相对分子质量比B大,则A、B可能是锌和铁;
故答案:(1)A;(2)A;(3)b.
(2)据图可以看出A产生的氢气少,B产生的氢气多,故填:A;
(3)金属与足量的酸反应时,当金属在生成物中的化合价相同时通常金属的相对原子质量越大,产生的氢气越少,由图象,观察反应速度A快和生成气体B多进行判断A比B活泼,A的相对分子质量比B大,则A、B可能是锌和铁;
故答案:(1)A;(2)A;(3)b.
点评:本题考查了金属与酸反应的速度以及产生氢气质量的关系,完成此题,可以依据已有的知识.所以要求同学们在平时的学习中加强基础知识的记忆和理解,以便能够灵活应用.

练习册系列答案
相关题目
下列事实和解释相符的是( )
| A、干冰用作制冷剂--干冰是冰 |
| B、用炭黑墨汁书写的字经久不变色--常温下,碳的化学性质稳定 |
| C、工业上用一氧化碳来炼金属--一氧化碳具有可燃性 |
| D、防毒面具里用活性炭来除去毒气--活性炭能和有毒物质发生化学反应 |
 小丽同学在参观生态农庄时收获很大,发现化学在生态农业方面发挥着重要作用.小丽同学发现农庄里使用大量材料:
小丽同学在参观生态农庄时收获很大,发现化学在生态农业方面发挥着重要作用.小丽同学发现农庄里使用大量材料: