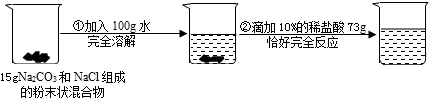
题目内容
请根据下列所示的实验过程和提供的数据,试回答下列问题: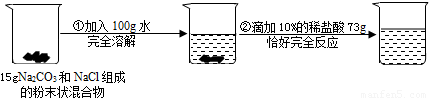
(1)在滴入稀盐酸的过程中,观察到的明显现象是______.
(2)该反应过程中生成的CO2气体的质量______.
(3)求最终所得溶液中溶质的质量是多少?(请写出规范的计算过程,并且最后结果保留一位小数)
【答案】分析:分析反应可发现,混合物中加入稀盐酸恰好完全反应,由于生成了二氧化碳,所以可观察到实验的明显现象,利用反应的氯化氢的质量即可求出反应的碳酸钠质量和产生二氧化碳的质量和氯化钠的质量;利用碳酸钠的质量可求出生成的氯化钠的质量和原样品中氯化钠的质量,进而求出反应后溶质的质量;
解答:解:(1)由于碳酸钠和盐酸反应会生成二氧化碳,所以观察到的明显现象是固体逐渐溶解,产生气泡;
(2)设:样品中碳酸钠的质量为x,生成氯化钠的质量为y.生成二氧化碳的质量是z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x 73g×10% y z
 =
=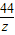
x=10.6 g y=11.7 g z=4.4g
(1)样品中氯化钠的质量为15g-10.6g=4.4g;故反应后氯化钠的质量为:4.4g+11.7 g=16.1 g
故答案为:(1)固体逐渐溶解,产生气泡;(2)4.4g;(3)最终所得溶液中溶质的质量是16.1g
点评:此题是一道根据化学方程式计算的考查题,解题时利用图示中的数据完成即可,特别是要注意原混合物中也存在氯化钠,所以反应后的溶质中既有原来的氯化钠也有生成的氯化钠;
解答:解:(1)由于碳酸钠和盐酸反应会生成二氧化碳,所以观察到的明显现象是固体逐渐溶解,产生气泡;
(2)设:样品中碳酸钠的质量为x,生成氯化钠的质量为y.生成二氧化碳的质量是z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x 73g×10% y z
 =
=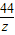
x=10.6 g y=11.7 g z=4.4g
(1)样品中氯化钠的质量为15g-10.6g=4.4g;故反应后氯化钠的质量为:4.4g+11.7 g=16.1 g
故答案为:(1)固体逐渐溶解,产生气泡;(2)4.4g;(3)最终所得溶液中溶质的质量是16.1g
点评:此题是一道根据化学方程式计算的考查题,解题时利用图示中的数据完成即可,特别是要注意原混合物中也存在氯化钠,所以反应后的溶质中既有原来的氯化钠也有生成的氯化钠;

练习册系列答案
相关题目