题目内容
(2012?河北)为测定实验室中某过氧化氢溶液的溶质质量分数,小明取25.0g过氧化氢溶液放入烧杯中,然后进行如图所示的实验.请计算:
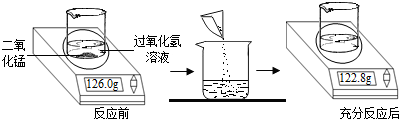
(1)反应后产生气体的质量为
(2)此过氧化氢溶液的溶质质量分数.

(1)反应后产生气体的质量为
3.2
3.2
g.(2)此过氧化氢溶液的溶质质量分数.
分析:(1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.因此完全反应后,物质减少的质量就是生成的气体质量;
(2)根据过氧化氢分解的化学方程式和(1)中计算出的氧气的质量,就可计算出参与反应的过氧化氢的质量,然后根据质量分数公式计算即可.
(2)根据过氧化氢分解的化学方程式和(1)中计算出的氧气的质量,就可计算出参与反应的过氧化氢的质量,然后根据质量分数公式计算即可.
解答:解:(1)根据质量守恒定律,反应生成氧气的质量=126.0g-122.8g=3.2g;
(2)解:设25.0 g过氧化氢溶液中含有过氧化氢的质量为x.
2H2O2
2H2O+O2↑
68 32
x 3.2g
=
解之得:x=6.8g,
过氧化氢的质量分数为:
×100%=27.2%,
答:该过氧化氢溶液中溶质的质量分数为27.2%.
(2)解:设25.0 g过氧化氢溶液中含有过氧化氢的质量为x.
2H2O2
| ||
68 32
x 3.2g
| 68 |
| 32 |
| x |
| 3.2g |
解之得:x=6.8g,
过氧化氢的质量分数为:
| 6.8g |
| 25.0g |
答:该过氧化氢溶液中溶质的质量分数为27.2%.
点评:本题主要考查学生根据质量守恒定律,运用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
 (2012?河北)如图所示的是几种常见物质的转化关系,其中A、B、C、D、E是单质,甲、乙、丙、丁是氧化物.已知:丙是红色固体,E是最清洁的燃料,丙高温下与乙反应可生成D.(部分反应物、生成物及反应条件己略去)请回答下列问题:
(2012?河北)如图所示的是几种常见物质的转化关系,其中A、B、C、D、E是单质,甲、乙、丙、丁是氧化物.已知:丙是红色固体,E是最清洁的燃料,丙高温下与乙反应可生成D.(部分反应物、生成物及反应条件己略去)请回答下列问题: