题目内容
【题目】实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴滴加到样品中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如下图所示。试回答:
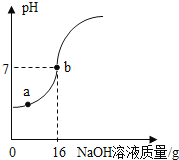
(1)a点溶液中含有的溶质有___________________________;
(2)途中b点表示的含义是:___________________________,此时消耗NaOH溶液中的NaOH的质量为_________g;
(3)计算稀H2SO4的溶质质量分数_____________。(写出计算过程,结果精确至0.1%)。
【答案】 H2SO4 , Na2SO4 硫酸和氢氧化钠恰好完全反应 0.8 (3)解:设10g稀硫酸中含H2SO4的质量为X
H2SO4 + 2NaOH== Na2SO4+2 H2O
98 80
X 0.8g
80:0.8g=98:X
X=0.98g
稀硫酸中H2SO4的质量分数为0.98g/10g×100%=9.8%
答:稀硫酸中溶质的质量分数为9.8%。
【解析】(1).氢氧化钠和硫酸反应生成硫酸钠和水, 所以当刚好完全反应时,溶质只有硫酸钠;酸过量时溶质为硫酸钠和硫酸,图中a点溶液的pH小于7,说明酸过量,所以溶质为H2SO4 , Na2SO4 (2). b点溶液的pH等于7, 硫酸和氢氧化钠恰好完全反应 (3). 此时消耗NaOH溶液中的NaOH的质量为16g×5%=0.8 (4). (3)解:设10g稀硫酸中含H2SO4的质量为X
H2SO4 + 2NaOH== Na2SO4+2 H2O
98 80
X 0.8g
80:0.8g=98:X
X=0.98g
稀硫酸中H2SO4的质量分数为0.98g/10g×100%=9.8%
答:稀硫酸中溶质的质量分数为9.8%。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案