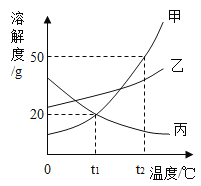
题目内容
【题目】人类生活和工农业生产都离不开水,下图是自来水厂净化水的示意图:
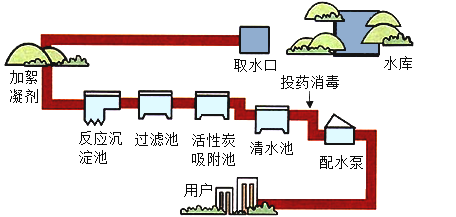
(1)自来水厂生产自来水时,使用的净水方法有 ___________(填序号)。
A 沉淀 B 过滤 C 煮沸 D 蒸馏 E 吸附
(2)下列行为属于节约用水的是_________(填序号)。
A 公共场所随手关闭水龙头 B 洗完菜的水用来浇花
C 不间断地放水刷牙 D 农业上为了灌溉更充分,通常采用大水漫灌
(3)高铁酸钠(Na2FeO4)是一种新型的净水剂,其中铁元素的化合价为_________。
(4)用工业明胶制成的医用“毒胶囊”中混有的重金属铬对人体有害。这里的铬是指_________ (填“元素”或“单质”或“原子”)。
(5)生活中用_________区分硬水和软水。
(6)X是一种新型的自来水消毒剂,工业上制取X的化学方程式为:Cl2+2NaClO2=2 X +2NaCl,则X的化学式为_________。
【答案】ABE AB +6 元素 肥皂水 ClO2
【解析】
(1)自来水厂生产自来水时,使用的净水方法有沉淀、过滤、吸附;
(2)公共场所随手关闭水龙头头,不会造成水的浪费;洗完菜的水用来浇花,符合节约用水的原则;不间断的放水刷牙,会造成水的浪费;农业上为了灌溉更充分,通常采用大水漫灌,不符合节约用水的原则;
(3)钠元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价;
(4)物质是由元素组成的,这里的“铬”是指元素;
(5)用肥皂水可以区分硬水和软水,泡沫多的是软水,泡沫少的是硬水;
(6)由质量守恒定律反应前后原子的种类和数目不变可知,在化学方程式为:Cl2+2NaClO2═2ClO2+2X 中反应前Cl原子有4个,Na原子有2个,O原子有4个,而反应后Cl原子有2个,Na原子有2个,所以2X中应有2个Cl原子,4个O原子,所以X的化学式为ClO2 。

【题目】如下图是实验室制取气体的发生装置和气体收集装置。请你回答下列问题:
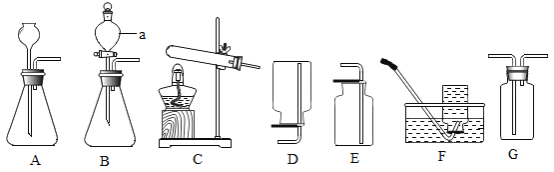
(1)仪器a的名称是________________________;
(2)实验室用过氧化氢溶液制取氧气,其反应的化学方程式是_______________________;若从控制反应速率和节约药品的角度考虑,应选择的发生装置是_______________________(填字母,下同)。
(3)实验室若用氯酸钾和二氧化锰(作催化剂)制取氧气,可选择装置_______________________作发生装置,其反应的化学方程式是________________________;
(4)D、E、F、G都是实验室中气体的收集装置,其中不能用来收集氧气的是________________________。
(5)某同学用上述(3)中的方法制取氧气,实验过程中试管发生了炸裂,请你帮他分析试管炸裂可能的原因是_______________________________________________。 (写一条即可)
(6)某校兴趣小组取氯酸钾和二氧化锰的混合物共3.0g放人大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
分析表中数据试计算原混合物中氯酸钾的质量分数是多少? ______________________(精确到0. 1%)