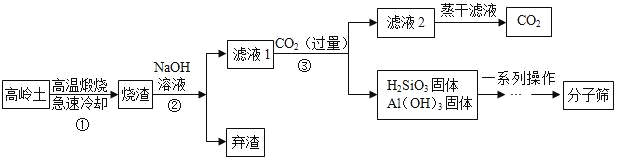
题目内容
【题目】根据下列实验装置图回答问题。
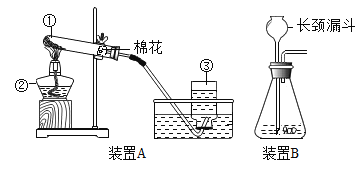
(1)写出上图中指定仪器的名称:①___________;③___________。
(2)写出用上图中的装置A制取氧气的化学方程式:_____________。
(3)利用装置A制氧气,棉花团的作用是___________;在结束实验时要先将导管撤离出水面,再熄灭酒精灯,其目的是____________。
(4)某同学在实验室里用高锰酸钾和二氧化锰加热制取氧气,实验结束时发现大试管已破裂,原因可能是①__________,②____________。
(5)现有氯酸钾和二氧化锰的混合物共26.5g,待反应不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g。求:
①制取氧气的质量_______。
②剩余固体中含有那些物质_______?各为_______克?
【答案】试管 集气瓶 2KMnO4![]() K2MnO4+MnO2+O2↑ 防止加热时高锰酸粉末通过导管进入水中 防止水槽中的水倒吸入试管,使试管因骤然冷却而炸裂 没有给试管均匀预热 试管外壁有水滴,试管口没有略向下倾斜,加热时试管与灯芯接触,收集完毕先撤去酒精灯等(任意两点即可) 9.6g 氯化钾和二氧化锰 氯化钾14.9g和二氧化锰2g
K2MnO4+MnO2+O2↑ 防止加热时高锰酸粉末通过导管进入水中 防止水槽中的水倒吸入试管,使试管因骤然冷却而炸裂 没有给试管均匀预热 试管外壁有水滴,试管口没有略向下倾斜,加热时试管与灯芯接触,收集完毕先撤去酒精灯等(任意两点即可) 9.6g 氯化钾和二氧化锰 氯化钾14.9g和二氧化锰2g
【解析】
(1)由图示可知,仪器的名称:①是试管,③是集气瓶。
(2)由装置A可知,是利用高锰酸钾制取氧气,反应的化学方程式是:2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
(3)利用装置A制氧气,棉花团的作用是:防止加热时高锰酸粉末通过导管进入水中;在结束实验时要先将导管撤离出水面,再熄灭酒精灯,其目的是:防止水槽中的水倒吸入试管,使试管因骤然冷却而炸裂。
(4)某同学在实验室里用高锰酸钾和二氧化锰加热制取氧气,实验结束时发现大试管已破裂,原因可能是:试管外壁有水滴,试管口没有略向下倾斜,加热时试管与灯芯接触,收集完毕先撤去酒精灯等(任意两点即可)。
(5)①该反应符合质量守恒定律,制取氧气的质量=26.5g-16.9g=9.6g。
②氯酸钾和二氧化锰混合制氧气反应原理:2KClO3![]() 2KCl+3O2↑,则剩余固体中含有氯化钾和二氧化锰;
2KCl+3O2↑,则剩余固体中含有氯化钾和二氧化锰;
设生成氯化钾的质量为x
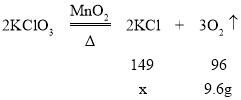
![]() x=14.9g
x=14.9g
氯化钾的质量为14.9g,二氧化锰的质量为26.5g-9.6g-14.9g=2g。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
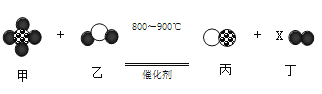
世纪百通优练测系列答案【题目】如图示为某化学反应的微观模拟反应示意图。下列对此物质发生的化学变化的说法中正确的是( )
A.原子分解成质子、中子和电子 | “●”氢原子;“○”氧原子;“ |
B.该化学变化发生的是化合反应 |
|
C.氢元素的化合价没有发生改变 | |
D.反应生成丁粒子的个数X为3 |
A.AB.BC.CD.D
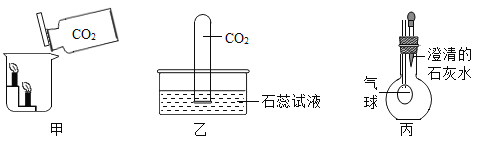
【题目】小王用图A所示装置对二氧化碳的灭火实验进行探究,观察到的现象是_____。实验的结论是_____
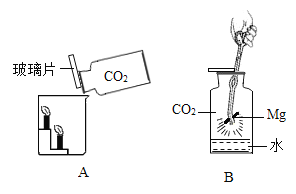
(提出问题)二氧化碳能否支持燃烧?
(猜想假设)镁能在二氧化碳中燃烧。
(查阅资料)①氧化镁、氢氧化镁均是白色难溶于水的固体。
②MgO+2HCl=MgCl2+H2O
③MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(实验探究)①图中镁带剧烈燃烧,冒白烟,有黑色固体生成,并放出大量的热。
②为检验生成物的成分,做如下实验。
实验步骤 | 实验现象 | 实验结论和化学方程式 |
向放有生成物的广口瓶中加入过量稀盐酸,充分反应后过滤,在滤纸上留有黑色固体 | ||
Ⅰ:将黑色固体收集、洗涤、干燥后,点燃,在火焰上方罩一个蘸有澄清石灰水的烧杯 | a:黑色固体燃烧,烧杯内壁出现白色浑浊 | b:黑色固体是_____;反应的化学方程式是: _____、_____ |
Ⅱ:取少量滤液于试管中,逐滴加入氢氧化钠溶液 | c:开始_____,后有白色沉淀产生 | d:白烟的成分是_____ |
(反思提高)实验室中某些活泼金属引起的着火,不能用二氧化碳灭火,应用细沙灭火。