题目内容
已知浓硫酸与焦炭在加热的条件下能发生反应,生成三种氧化物。某校研究性学习小组对此进行以下一系列的探究活动。
【提出猜想】浓硫酸与焦炭在加热条件下反应,生成H2O、SO2和CO2。
【提出猜想】浓硫酸与焦炭在加热条件下反应,生成H2O、SO2和CO2。
【查阅资料】经查阅资料得知:①CO2、SO2均可使澄清石灰水变浑浊;
②SO2可使品红溶液 的红色褪去,而CO2不能;
③SO2可与酸性的KMnO4溶液反应使其褪色,而CO2不能;
④无水CuSO4为白色粉末,遇水可生成蓝色胆矾。
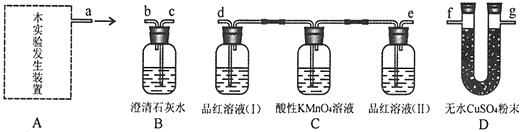
【实验探究】用以下A-D四个装置组装成一套完整的实验装置,然后进行实验,验证猜想。
(1)本实验的发生装置应选用如下图所示三种装置中的_______装置(填序号)。
②SO2可使品红溶液 的红色褪去,而CO2不能;
③SO2可与酸性的KMnO4溶液反应使其褪色,而CO2不能;
④无水CuSO4为白色粉末,遇水可生成蓝色胆矾。
【实验探究】用以下A-D四个装置组装成一套完整的实验装置,然后进行实验,验证猜想。
(1)本实验的发生装置应选用如下图所示三种装置中的_______装置(填序号)。

(2)为了验证三种产物,达到预期的实验目的,整套实验装置的正确组装顺序是(按导管口 连接的先后顺序):发生装置导管口
(3)实验过程中,同学们观察到装置D中的无水CuSO4变为蓝色,由此得出产物中有________的结论;同时还观察到以下实验现象:装置C中品红溶液(Ⅰ)和酸性高锰酸钾溶液都褪色,品红溶液(Ⅱ)不褪色;装置B中澄清石灰水变浑浊。装置C中品红溶液(Ⅰ)褪色,说明产物中有____,酸性KMnO4溶液的作用是____, 品红溶液(Ⅱ)不褪色,说明________;装置B中发生反应的化学方程式是__________________。
(4)能确认反应产物中有CO2的实验现象是_______________。
【实验结论】本实验提出的猜想____(填“成立”或“不成立”);浓硫酸与木炭反应的化学方程式是_______________。
【交流讨论】实验结束后,同学们针对本实验进行讨论,其中张辉同学提出了“反应产物中可能还有一氧化碳”这样的一个观点。你是否支持张辉同学的观点?_________(填“支持”或“不支持”),请你说出两点理由:①__________;②______________。

(3)实验过程中,同学们观察到装置D中的无水CuSO4变为蓝色,由此得出产物中有________的结论;同时还观察到以下实验现象:装置C中品红溶液(Ⅰ)和酸性高锰酸钾溶液都褪色,品红溶液(Ⅱ)不褪色;装置B中澄清石灰水变浑浊。装置C中品红溶液(Ⅰ)褪色,说明产物中有____,酸性KMnO4溶液的作用是____, 品红溶液(Ⅱ)不褪色,说明________;装置B中发生反应的化学方程式是__________________。
(4)能确认反应产物中有CO2的实验现象是_______________。
【实验结论】本实验提出的猜想____(填“成立”或“不成立”);浓硫酸与木炭反应的化学方程式是_______________。
【交流讨论】实验结束后,同学们针对本实验进行讨论,其中张辉同学提出了“反应产物中可能还有一氧化碳”这样的一个观点。你是否支持张辉同学的观点?_________(填“支持”或“不支持”),请你说出两点理由:①__________;②______________。
(1)③
(2)f→g→d→e→c(f、g顺序可颠倒)
(3)H2O(水);SO2(二氧化硫);除去SO2;SO2已除尽;CO2+Ca(OH)2==CaCO3↓+H2O
(4)装置C中品红溶液(Ⅱ)不褪色,装置B中澄清石灰水变浑浊(只答对其中一点,不给分)
【实验结论】成立;C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O
2SO2↑+CO2↑+2H2O
【交流讨论】支持;①根据质量守恒定律,反应前后元素种类不变;②碳的氧化物有CO和CO2
(2)f→g→d→e→c(f、g顺序可颠倒)
(3)H2O(水);SO2(二氧化硫);除去SO2;SO2已除尽;CO2+Ca(OH)2==CaCO3↓+H2O
(4)装置C中品红溶液(Ⅱ)不褪色,装置B中澄清石灰水变浑浊(只答对其中一点,不给分)
【实验结论】成立;C+2H2SO4(浓)
 2SO2↑+CO2↑+2H2O
2SO2↑+CO2↑+2H2O【交流讨论】支持;①根据质量守恒定律,反应前后元素种类不变;②碳的氧化物有CO和CO2

练习册系列答案
相关题目




 x Fe+y H2O,Fe3C+2H2
x Fe+y H2O,Fe3C+2H2

 x Fe + y H2O,Fe3C + 2H2
x Fe + y H2O,Fe3C + 2H2 3 Fe + CH4。
3 Fe + CH4。
 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。