题目内容
【题目】某实验小组利用废硫酸液制备K2SO4并研究CaSO42H2O加热分解的产物. (一)K2SO4的制备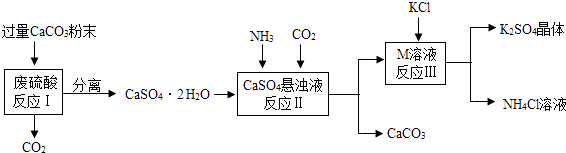
(1)将CaCO3研成粉末的目的是
(2)上述流程中可循环使用的物质有CO2和(填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入(选填序号,下同),振荡、静置,再向上层清液中滴加 , 观察现象即可判断. a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(5)(二)研究CaSO42H2O加热分解的产物. 分离所得的CaSO42H2O含有CaCO3 , 可用盐酸除去,该的化学反应方程式 .
(6)为了测定CaSO42H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验. 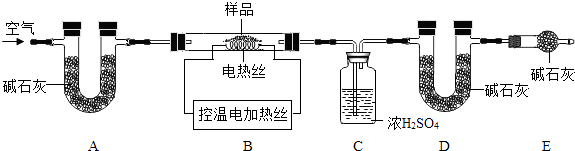
①实验前首先要 , 再装入样品.装置A的作用是 .
②已知CaSO42H2O在160℃生成CaSO4 , 1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将(填“偏大”、“偏小”或“无影响”).你认为还可选用上述的(选填序号)两个数据组合也可求出x:y的值.
(7)CaSO42H2O受热会逐步失去结晶水.取纯净CaSO42H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 . 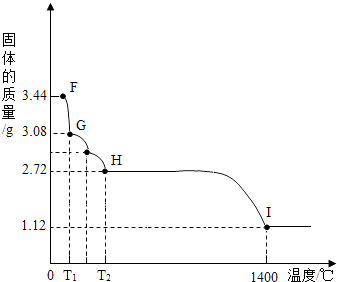
②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 .
【答案】
(1)加快反应速率
(2)CaCO3
(3)常温下K2SO4的溶解度小
(4)减少K2SO4的溶解;c;a
(5)CaCO3+2HCl=CaCl2+CO2↑+H2O
(6)检查装置的气密性;除去空气中的CO2和H2O;偏小;bc
(7)CaSO4?H2O;2CaSO4 ![]() 2CaO+2SO2↑+O2↑
2CaO+2SO2↑+O2↑
【解析】解:(1)将CaCO3研成粉末,可以增大反应物的接触面积,其目的是加快反应速率.(2)观察上述流程,发现二氧化碳和碳酸钙既是反应物也是生成物,故可循环使用的物质有CO2和CaCO3 . (3)根据复分解反应发生的条件,反应Ⅲ中虽没有不溶物,但常温下K2SO4的溶解度小,在生成物中会以沉淀的形式出现,故反应可以进行.(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是减少K2SO4的溶解;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,目的是除去硫酸根,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净.(5)碳酸钙能与稀盐酸反应,硫酸钙和稀盐酸不反应,故分离所得的CaSO42H2O含有CaCO3 , 可用盐酸除去,该的化学反应方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.(6)为了测定CaSO42H2O和CaCO3的质量比x:y,①实验前首先要检查装置的气密性,再装入样品.装置A的作用是除去空气中的CO2和H2O,防止它们影响实验结果.②装置E的作用是吸收空气中的水和二氧化碳,如没有装置E,则实验测定结果将偏小.通过装置C可确定生成水的质量,故还可选用上述的bc两个数据组合也可求出x:y的值.(7)CaSO42H2O受热会逐步失去结晶水.取纯净CaSO42H2O固体,放在(5)的实验装置B中进行加热,①G点处减少的质量是失去了部分结晶水后的质量,故此时固体的化学式是CaSO4H2O.②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,说明生成了二氧化硫气体,则H~I段发生反应的化学方程式为 2CaSO4 ![]() 2CaO+2SO2↑+O2↑. 所以答案是:(1)加快反应速率(或使反应更充分或提高原料的利用率等合理答案均给分).(2)CaCO3(3)常温下K2SO4的溶解度小.(4)减少K2SO4的溶解.c a(5)CaCO3+2HCl=CaCl2+CO2↑+H2O(6)①检查装置的气密性. 除去空气中的CO2和H2O(意思相近均给分).②偏小 b、c(7)①CaSO4H2O ②2CaSO4
2CaO+2SO2↑+O2↑. 所以答案是:(1)加快反应速率(或使反应更充分或提高原料的利用率等合理答案均给分).(2)CaCO3(3)常温下K2SO4的溶解度小.(4)减少K2SO4的溶解.c a(5)CaCO3+2HCl=CaCl2+CO2↑+H2O(6)①检查装置的气密性. 除去空气中的CO2和H2O(意思相近均给分).②偏小 b、c(7)①CaSO4H2O ②2CaSO4 ![]() 2CaO+2SO2↑+O2↑
2CaO+2SO2↑+O2↑
【考点精析】本题主要考查了书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握注意:a、配平 b、条件 c、箭号才能正确解答此题.

【题目】盐城盛产的松花蛋,又称皮蛋,其中一种加工工艺的主要原料配方为:鸭蛋10kg,水10kg.生石灰1.2kg,纯碱0.53kg,食盐0.35kg,加工时,将纯碱,食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后得到料液,再加入鸭蛋浸渍. 请回答下列问题:
(1)鸭蛋中富含的营养素有水和 .
(2)生石灰加入沸水中,水能持续保持沸腾,其原因是 .
(3)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为色.
(4)同学们对上层料液的成分产生了兴趣,请你一起参与他们的探究活动. 【提出问题】料液中含有哪些溶质?
【交流讨论】①一定含有NaOH,NaCl;
②可能还含有其它溶质,
甲同学推断只有Ca(OH)2 ,
乙同学推断只有Na2CO3 ,
丙同学推断既有Ca(OH)2 , 也有Na2CO3;
通过进一步讨论,大家一致认为丙同学的推断是错误的,理由是(用化学方程式表示).
【实验探究】
实验步骤 | 实验现象 |
取少量上层料液,滴加稀盐酸 | 无明显现象 |
另取少量上层料液,滴加碳酸钠溶液 | 产生白色沉淀 |
【探究结论】同学的推断是正确的.
【知识应用】①皮蛋食用时加入一些食醋,可以去除氨味和涩感,原因是 .
②料液中起主要作用的是烧碱,现行配方中,直接用烧碱代替石灰和纯碱作用生成的烧碱,若加工10kg的鸭蛋,需要烧碱的质量是多少千克?(请写出计算过程).