��Ŀ����
����Ŀ����2016�갲��ʡ��ij�о�С����Զ���������ʾ��ͼ���£���������̽����
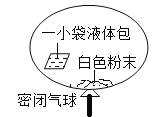
���������ϡ��÷�Ӧ����ԭ���ǣ�ͨ������Һ�����ʹҺ�����ɫ��ĩ�Ӵ�����������̼���壬ʵ�������Զ�������
��1��Ϊ���������Ƕ�����̼����ѡ�� �����Լ����ƣ���
̽��һ��Һ�������Һ����Ե�̽��
��2������ʱ����pH��ֽ�����Һ��pH=3������Һ�� �ԡ�
̽��������ɫ��ĩ�ɷֵ�̽��
����������衿��ͬѧ��Ϊ��̼��ƣ���ͬѧ��Ϊ��̼���ƣ���ͬѧ��Ϊ��̼�����ơ�
����Ʋ�����ʵ�顿
��3����������ɫ��ĩ����ˮ�н��裬����ȫ���ܽ⣬˵����ͬѧ�IJ��� �����ȷ������ȷ����
��4������ʱ���ֱ���ʢ��̼�����ơ�̼���ƺͰ�ɫ��ĩ��Ʒ����ƿ��ע��������������10%���ᣨװ������ͼ������¼���±���
ʵ���� | ��ƿ������ | ���յõ�CO2���/mL | |
���� | ����/g | ||
�� | ̼������ | 0.10 | V1 |
�� | ̼���� | 0.10 | V2 |
�� | ��ɫ��ĩ | a | V1 |
ʵ��ٵĻ�ѧ����ʽΪ ������a= ��V1 V2�����������������=������

���������ó����ۡ�
��5����δ��ϱ��л�ȡ֤�ݲ��ó����ۣ� ��
���𰸡���1������ʯ��ˮ��2���ᣨ3������ȷ��4��NaHCO3+HCl==NaCl+H2O+CO2�� 0.10 ��
��5�����ݱ���CO2�������ƿ������������ϵ��ʵ�����ʵ�����ͬ���ɵó���ɫ��ĩ�ijɷ�Ϊ̼�����ƣ������𰸼��ɣ�
����������1�����������̼�ó���ʯ��ˮ
��2��pH��7����Һ�Լ��ԣ�pH =7����Һ�����ԣ�pH��7����Һ�����ԣ��ʵ���Һ��pH=3������Һ������
��3��̼������ܽ���ˮ
��4��̼�����������ᷴӦ�Ļ�ѧ����ʽΪ��NaHCO3+HCl==NaCl+H2O+CO2�� ���Ա�ʵ��ʱҪ���Ʊ�������a=0.10 ��0.10 g̼���������ᷴӦ���ɶ�����̼������Ϊx, 0.10 g̼�����������ᷴӦ���ɶ�����̼������ Ϊy
Na2CO3+2HCl==2NaCl+CO2��+H2O NaHCO3+HCl==NaCl+CO2��+H2O
106 44 84 44
0.10 g x 0.10 g y
106 : 44= 0.10 g : x ���x=4.4g��106 84 :44= 0.10 g :y ���y=4.4g��84
��̼�����������ᷴӦ���ɵĶ�����̼�࣬ͬ��ͬѹ�£����������Խ�����Խ��V1��V2
��5�����ݱ���CO2�������ƿ������������ϵ��ʵ�����ʵ�����ͬ���ɵó���ɫ��ĩ�ijɷ�Ϊ̼������

 Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�