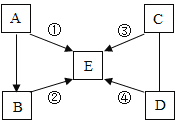
题目内容
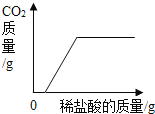
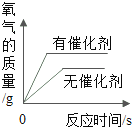
【题目】在一烧杯中盛有由 Na2CO3和 NaCl 组成的固体混合物 20g,向其中逐渐滴加溶质质量分数为 10%的稀盐酸,放出气体的质量与滴入稀盐酸的质量关系如图所示。请分析曲线图后回答下列问题:
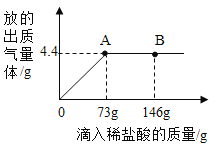
(1)当滴加稀盐酸至图中 A 点时,溶液中的溶质为_____________(填化学式)。当滴加稀盐酸至图中 B 点时,烧杯中溶液的 pH ___________7(填 “>”或“=”或“<”)。
(2)计算原固体混合物中氯化钠的质量分数_______。
【答案】NaCl < 47%
【解析】
(1)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳。A点后气体的质量不再增加,所以A点为恰好完全反应,所以溶液中的溶质的化学式为 NaCl;当滴加稀盐酸至图中B点时,盐酸剩余,溶液显酸性,所以烧杯中溶液的 pH <7;
(2)A点后气体的质量不再增加,所以A点为恰好完全反应,此时消耗的HCl的质量为73g×10%=7.3g,设消耗的碳酸钠的质量为x,
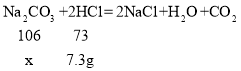
![]()
x=10.6g,
原固体混合物中氯化钠的质量分数为:![]() 。
。

【题目】某实验小组在探究碱的化学性质实验时,用到了氢氧化钠溶液和氢氧化钙溶液。
(1)甲同学不小心将这两种溶液混合在一起,结果产生_______的现象,说明氢氧化钠溶液变质了。写出变质时发生反应的化学方程式_______。
(2)同学们对变质的氢氧化钠溶液中溶质的成分产生了兴趣,进行如下探究:
[提出问题]氢氧化钠溶液中溶质的成分是什么?
[做出猜想]猜想一: Na2CO3
猜想二: ______(写化学式)
[进行讨论]甲同学取少量待测液加入足量的稀盐酸,有气泡产生。认为猜想一成立。乙同学不同意甲同学的观点,理由是_______。
[设计实验]请你验证猜想二成立,并完成实验报告。
实验操作 | 实验现象 | 实验结论 |
①取一定量的待测液于试管中,加入______溶液。 ②充分反应后静置,取上层清液加入无色酚酞溶液 | ①_______ ②_______ | 猜想二成立 |
[反思评价]在实验室中,氢氧化钠应_________保存。