题目内容
【题目】下列物质是初中化学常见的物质。X是胃酸的主要成分;A、B均能与X反应生成C、D、E三种物质;C是厨房中常用的调味品;E是气体;D与白色固体G反应生成H;H常用于改良酸性土壤;H能与B反应生成白色沉淀F和另一种物质Y。
(1)X的化学式为______。
(2)Y的俗名为_____。
(3)E的用途为______。
(4)写出D与G反应的方程式为______,此反应______热(填“放”或“吸”)。
(5)A受热易分解生成B,写出该反应的方程式______。
【答案】HCl 烧碱(或火碱、苛性钠) 灭火(或人工降雨、舞台云雾、气肥、碳酸饮料) ![]() 放
放 ![]()
【解析】
D与白色固体G反应生成H;H常用于改良酸性土壤,则H是氢氧化钙,水与氧化钙反应生成氢氧化钙,故D是水,G是氧化钙;X是胃酸的主要成分,则X是盐酸;A、B均能与X反应生成C、D、E三种物质,C是厨房中常用的调味品,E是气体,则C是氯化钠,A、B分别是碳酸钠或碳酸氢钠,E是二氧化碳气体;H能与B反应生成白色沉淀F和另一种物质Y,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,故B是碳酸钠,A是碳酸氢钠,F是碳酸钙,Y是氢氧化钠。经过验证,推测合理。
(1)X是盐酸,化学式为HCl。
(2)Y是氢氧化钠,俗名为烧碱、火碱或苛性钠。
(3)E是二氧化碳气体,可用于作灭火剂。
(4)D与G反应是氧化钙与水反应生成氢氧化钙,反应方程式为![]() ,此反应放热。
,此反应放热。
(5)A是碳酸氢钠,受热易分解生成碳酸钠、水和二氧化碳,反应的方程式为![]() 。
。

 寒假学与练系列答案
寒假学与练系列答案【题目】某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
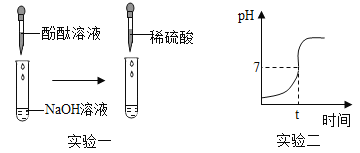
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | _____ | 氢氧化钠和硫酸发生了化学反应 |
(拓展延伸)在实验室,某同学将氢氧化钠溶液逐滴滴入稀硫酸和硫酸铜的混合溶液中至过量。加入氢氧化钠溶液的质量(横轴)与生成沉淀质量(纵轴)的关系如图所示:
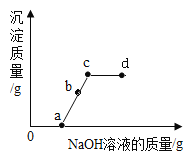
(1)图中a→c线段对应的现象是_____;
(2)图中b点处溶液中的溶质是_____;
(3)实验结束后(图中d点处)的溶液不能直接向外排放的原因是_____。
【题目】某兴趣小组的同学在做完酸、碱、盐相关性质的实验后,把稀盐酸、氢氧化钾溶液和碳酸钾溶液混合在一起,观察到有大量气泡产生,他们对反应后溶液中溶质的成分感到好奇并进行实验探究。
(查阅资料)碳酸钾溶液呈碱性。
(提出问题)反应后溶液中溶质的成分是什么?
(做出猜想)猜想①:KCl、K2CO3;猜想②:KCl、HCl;猜想③:KCl;猜想④:KCl、HCl、K2CO3;猜想⑤:KCl、K2CO3、KOH。
上述猜想中,你认为不合理的是猜想_____(填序号),理由是_____;
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
Ⅰ、取少量反应后的溶液于试管中,向其中加入过量的BaCl2溶液,充分反应后过滤 | _____ | 猜想②、③不成立 |
Ⅱ、取步骤Ⅰ后的上层清液,向其中滴加无色酚酞溶液 | _____ | 猜想⑤成立 |
(拓展应用)
(1)写出实验步骤Ⅰ中发生反应的化学方程式:_____;
(2)在确定化学反应后所得液体的溶质成分时,除了考虑生成物外,还要考虑_____。