题目内容
(2002?新疆)某工厂化验室用40g溶质质量分数为15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,洗涤后溶液中性,问在这一定量的石油产品里含H2SO4多少克?
分析:洗涤后溶液中性,说明洗涤用氢氧化钠与一定量石油产品中的残余硫酸恰好完全反应;利用反应的化学方程式,由所用氢氧化钠的质量计算出产品中的残余硫酸质量.
解答:解:设含有H2SO4的质量为x
洗涤用溶液中NaOH的质量=40g×15%=6g
2NaOH+H2SO4=Na2SO4+2H2O
80 98
6g x
=
x=7.35g
答:在这一定量的石油产品里含H2SO4为7.35g
洗涤用溶液中NaOH的质量=40g×15%=6g
2NaOH+H2SO4=Na2SO4+2H2O
80 98
6g x
| 80 |
| 98 |
| 6g |
| x |
答:在这一定量的石油产品里含H2SO4为7.35g
点评:一般说来,碱与酸发生中和反应,当两种反应物恰好完全反应时所得溶液酸碱度为7,溶液呈中性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
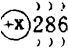 ,则它的核电荷数为( )
,则它的核电荷数为( )