题目内容
某化学兴趣小组探究物质燃烧的条件及铁燃烧现象.
[提出问题1]物质燃烧需要什么条件?
[猜想与假设]1.有可燃物 2.温度要达到着火点 3.与氧气(或空气)接触
[设计与实验1]
[得出结论]猜想正确,燃烧必须同时满足3个条件,只要破坏1个燃烧的条件,就能达到灭火的目的.
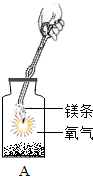
[提出问题2]根据“细铁丝在氧气中燃烧”的实验现象,细铁丝在氧气中燃烧为什么会“火星四射”?
[查阅资料1]含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡,熔融液态物质因气泡炸裂引起“火星四射”的现象.
[设计与实验2]小明对铁丝在氧气中燃烧为什么会火星四射进行探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录.
请你分析回答:
[查阅资料2]镁条能在空气中剧烈燃烧,也能在二氧化碳中剧烈燃烧,发出耀眼的白光、放出大量的热,有黑色固体生成;细铁丝可以在氯气中剧烈燃烧,放出大量的热,产生大量棕黄色的烟;磷能在氯气中剧烈燃烧,放出大量的热,产生大量的白色烟雾.
回答下列问题:
(1)将两个[设计与实验]表格中的有关内容填写完整:
(2)完成化学反应方程式:
①铁在氧气中燃烧:______;
②镁在二氧化碳中燃烧:______.
(3)完成本探究活动,你对“燃烧”有什么新认识?______.
(4)设计对比实验的关键是什么?______.
[提出问题1]物质燃烧需要什么条件?
[猜想与假设]1.有可燃物 2.温度要达到着火点 3.与氧气(或空气)接触
[设计与实验1]
| 验 证 | 对比试验 | |
| 假设1 | 示例:加热烧杯,烧杯不可燃 | 点燃蜡烛,蜡烛可燃 |
| 假设2 | 常温放置蜡烛,蜡烛不燃烧 | ______ |
| 假设3 | 点燃蜡烛,蜡烛在空气中持续燃烧 | ______ |
[提出问题2]根据“细铁丝在氧气中燃烧”的实验现象,细铁丝在氧气中燃烧为什么会“火星四射”?
[查阅资料1]含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡,熔融液态物质因气泡炸裂引起“火星四射”的现象.
[设计与实验2]小明对铁丝在氧气中燃烧为什么会火星四射进行探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录.
请你分析回答:
| 物质 | 镁条 | 含碳0.05%的铁丝 | ||
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
回答下列问题:
(1)将两个[设计与实验]表格中的有关内容填写完整:
(2)完成化学反应方程式:
①铁在氧气中燃烧:______;
②镁在二氧化碳中燃烧:______.
(3)完成本探究活动,你对“燃烧”有什么新认识?______.
(4)设计对比实验的关键是什么?______.
【设计与实验】明白物质燃烧所需要的条件,即物质具有可燃性、达到着火点、与氧气接触.从假设1可知烧杯是不可燃烧的物质,后面的就要填写可燃物;假设2是常温放置蜡烛,蜡烛不燃烧,说明蜡烛没有达到着火点;假设3是点燃蜡烛,蜡烛在空气中持续燃烧,说明燃烧时必须可燃物与氧气充分接触;
由前两项对比可知铁丝含碳量越高火星越多,所以未填内容应为含碳量依次升高,反应时火星越来越多所以答案为:
(2)①铁在氧气中燃烧的反应物是铁和氧气,生成物是四氧化三铁,用观察法配平,反应条件是点燃,所以方程式是:3Fe+2O2
Fe3O4;②镁在二氧化碳中燃烧的反应物是镁和二氧化碳生成物是氧化镁和碳,用观察法配平,所以方程式是2Mg+CO2
2MgO+C;
(3)通过资料中的信息,“镁条能在空气中剧烈燃烧,也能在二氧化碳中剧烈燃烧,发出耀眼的白光、放出大量的热;细铁丝可以在氯气中剧烈燃烧,放出大量的热,产生大量棕黄色的烟;磷能在氯气中剧烈燃烧,放出大量的热,产生大量的白色烟雾.”可知燃烧是发光、放热的剧烈化学反应,燃烧不一定有氧气参加;
(4)设计对照实验时要注意只能有一个变量,其它量必须相同.
故答案为:(1)
(2)①3Fe+2O2
Fe3O4;②2Mg+CO2
2MgO+C;(3)燃烧不一定有氧气参加;(4)只允许有一个变量,其它量必须相同.
由前两项对比可知铁丝含碳量越高火星越多,所以未填内容应为含碳量依次升高,反应时火星越来越多所以答案为:
| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
剧烈燃烧 少量火星 |
剧烈燃烧,火星四射 |
| ||
| ||
(3)通过资料中的信息,“镁条能在空气中剧烈燃烧,也能在二氧化碳中剧烈燃烧,发出耀眼的白光、放出大量的热;细铁丝可以在氯气中剧烈燃烧,放出大量的热,产生大量棕黄色的烟;磷能在氯气中剧烈燃烧,放出大量的热,产生大量的白色烟雾.”可知燃烧是发光、放热的剧烈化学反应,燃烧不一定有氧气参加;
(4)设计对照实验时要注意只能有一个变量,其它量必须相同.
故答案为:(1)
| 验 证 | 对比试验 | |
| 假设1 | 示例:加热烧杯,烧杯不可燃 | 点燃蜡烛,蜡烛可燃 |
| 假设2 | 常温放置蜡烛,蜡烛不燃烧 | 温度要达到着火点 |
| 假设3 | 点燃蜡烛,蜡烛在空气中持续燃烧 | 与氧气(或空气)接触 |
| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
剧烈燃烧 少量火星 |
剧烈燃烧,火星四射 |
| ||
| ||

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
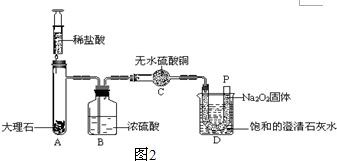
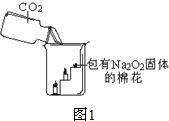 25、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
25、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.