题目内容
【题目】一包白色固体可能含有 Ba(NO3)2、NaCl、NaOH、Na2SO4、CuSO4 中的一种或几种。为确定其组成,某同学设计了如下实验方案:
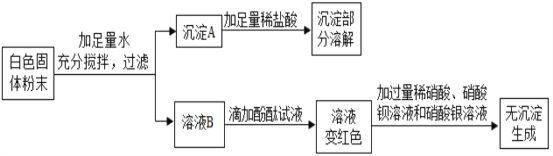
下列判断正确的是
A. 原固体中一定有Ba(NO3)2、NaOH、CuSO4 和Na2SO4
B. 沉淀 A 中一定有Cu(OH)2 和BaSO4
C. 溶液 B 中一定有NaOH 和 Na2SO4,一定没有CuSO4
D. 原固体中一定没有 NaCl和Na2SO4
【答案】B
【解析】硫酸铜和氢氧化钠反应生成蓝色的氢氧化铜沉淀,氢氧化铜沉淀溶于酸,硝酸钡和硫酸钠反应生成不溶于酸的硫酸钡沉淀,碱溶液能使酚酞变红色,硫酸根离子和钡离子反应硫酸钡沉淀,氯离子和银离子反应会生成氯化银沉淀。白色固体粉末加入足量的水水后,得到沉淀A和溶液B,沉淀A中加入稀盐酸,部分溶解,所以沉淀A中一定含有氢氧化铜沉淀和硫酸钡沉淀,白色固体粉末中一定含有硝酸钡、氢氧化钠、硫酸铜,可能含有硫酸钠,溶液B中加入酚酞,溶液变红色,所以B中一定含有氢氧化钠,加入足量的硝酸、硝酸钡、硝酸银,无沉淀生成,所以白色固体粉末中一定不含氯化钠,因此:
A、原固体中一定有 Ba(NO3)2、NaOH、CuSO4,可能含有Na2SO4,错误;
B、沉淀A中一定有 Cu(OH) 2 和 BaSO4,正确;
C、溶液B中一定有 NaOH,一定没有Na2SO4和CuSO4,错误;
D、原固体中一定没有NaCl,可能含有Na2SO4,错误。故选B。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
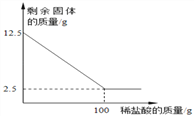
全能闯关100分系列答案【题目】一些骗子常用黄铜冒充黄金骗取钱财,某同学通过查阅资料得知黄铜是锌和铜的合金,他取一定量的某黄铜样品放入烧杯中,再向其中分4次加入等质量的同一稀硫酸,每次均充分反应。实验过程中有关物质的用量及质量测定记录如下表:
实验次数 | 1 | 2 | 3 | 4 |
稀硫酸的用量/g | 20 | 20 | 20 | 20 |
剩余固体的质量 | 10 | 8.7 | 7.4 | 7.2 |
分析表中数据,完成下列问题:
(1)所取黄铜样品的质量为___________ g;
(2)第4次实验结束后溶液的pH __________7(填“>”、“=”或“<”);
(3)所用稀硫酸中溶质的质量分数为________________?(要求有解答过程)
【题目】FeCl2溶液中混有少量的CuCl2,为了除去CuCl2,某课外小组同学取该溶液50g于烧杯中,然后等量分5次加入某物质M充分反应,所得数据如下表,请根据相关知识和数据回答下列问题:
次数 | 1 | 2 | 3 | 4 | 5 |
加入M的质量(g) | 0.28g | 0.28g | 0.28g | 0.28g | 0.28g |
溶液的总质量(g) | 49.96 g | 49.92 g | 49.88g | 49.84g | 49.84g |
(1)写出物质M的化学式______.
(2)参加反应M的总质量是________?
(3)FeCl2溶液中CuC12的质量分数是_______?