题目内容
氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。铁酸锌(ZnFe2O4)可用于循环分解水制取氢气,下列关于铁酸锌的说法正确的是()
A. 含有2个氧分子
B. 由两种金属和一种非金属组成
C. 铁元素的化合价为+3
D. Zn、Fe、O三种元素的质量比为1:2:4
 阅读快车系列答案
阅读快车系列答案化学就在我们身边,下列知识归的完全正确的一组是
A.化学与生活 | B.化学与健康 |
①用洗洁精清洗手上的油渍属于乳化作用 ②用灼烧的方法区分羊毛和涤纶 | ①人体缺铁会导致骨质硫松 ②食用牛奶可以补充蛋白质 |
C.化学与安全 | D.化学与资源 |
①皮肤沾上浓硫酸涂抹氢氧化钠溶液 ②点燃可燃性气体前一定要验纯 | ①煤、石油、天然气是三大化石燃料 ②塑料、合成纤维和合成橡胶属于三大有机合成材料 |
A. A B. B C. C D. D
等质量的铁粉与过量的盐酸在不同的实验条件下进行反应,测定在相同时间t内产生气体体积V的数据,根据数据绘制得到图1。


组别 | 盐酸的溶质质量分数/% | 温度/℃ |
① | 7 | 30 |
② | 10 | 50 |
③ | 7 | 20 |
④ | 10 | 30 |
(1)请写出铁粉与稀盐酸反应的化学方程式: ________________。
(2)通过实验①③对比,得出的结论是________________;要比较盐酸的溶质质量分数对反应快慢的影响,应选择的实验组别是________________。
(3)实验中产生气体“逐渐变快又变慢”的原因是_______________; ____________________。
(进一步探究)图甲、图乙为利用数字化仪器测得的室温下足量的三种金属片分别与20 mL 10%的稀盐酸反应产生氢气的量(产生氢气的量由气体压强表示,在等温条件下,产生氢气的体积与装置内压强成正比)。
①实验中你认为还要控制的变量是________________。
②根据图乙,你得出的反应物的量与生成的气体体积的关系是____________________。
(注意:若答对下列问题奖励4分,化学试卷总分不超过60分。)
(拓展提高)图2为测得的室温下足量的镁片与20 mL 10%的稀盐酸反应产生氢气的量与时间的关系曲线,发现实验测得的实际值比通过计算得到的理论值偏大,请分析可能的原因(至少答两点):
①_____________________;②__________________________



 ;③按木炭的量不同,反应顺序是
;③按木炭的量不同,反应顺序是 ;
; ;
; 。
。 探究影响物质溶解性的因素
探究影响物质溶解性的因素 探究分子运动
探究分子运动 探究MnO2能否加快H2O2分解
探究MnO2能否加快H2O2分解 除去CO中的CO2气体
除去CO中的CO2气体
 向一定体积HCl溶液中滴加NaOH溶液
向一定体积HCl溶液中滴加NaOH溶液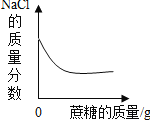 t1℃,向一定量饱和NaCl溶液中不断加入蔗糖
t1℃,向一定量饱和NaCl溶液中不断加入蔗糖 向一定量的HCl和CaCl2混合液中滴入Na2CO3溶液
向一定量的HCl和CaCl2混合液中滴入Na2CO3溶液 向CuCl2和H2SO4的混合液中加入过量Ba(OH)2溶液
向CuCl2和H2SO4的混合液中加入过量Ba(OH)2溶液