题目内容
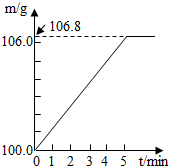
某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氨气用100.0g废硫酸(足量)吸收.测得吸收氨气的溶液总质量m与反应时间的变化如图所示.(所涉及反应(NH4)SO4+2NaOH=Na2SO4+2H2O+NH3↑;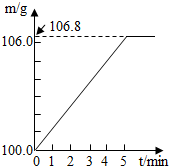
2NH3+H2SO4=(NH4)2SO4)
请计算:
(1)完全反应后产生氨气质量为________.
(2)该化肥的含氮量为多少?写出解题过程.通过计算判断这种化肥是否合格?
解:(1)根据质量守恒定律结合题中图示可知生成的氨气质量为106.8g-100g=6.8g;故答案为:6.8g;
(2)根据质量守恒定律氨气中的氮元素质量即硫酸铵化肥中氮元素的质量,氨气中氮元素的质量为6.8g× ×100%=5.6g,故化肥中氮元素的质量分数为
×100%=5.6g,故化肥中氮元素的质量分数为 ×100%=20.4%>20%,所以为合格化肥.故答案为:20.4%;合格.
×100%=20.4%>20%,所以为合格化肥.故答案为:20.4%;合格.
分析:(1)运用质量守恒定律解答;
(2)运用质量守恒定律和根据化学式的计算解答.
点评:本题是综合性计算题,考查质量守恒定律的计算、侧重计算能力的考查,平时学习时一定注意多做多总结规律,寻找解题思路.
(2)根据质量守恒定律氨气中的氮元素质量即硫酸铵化肥中氮元素的质量,氨气中氮元素的质量为6.8g×
 ×100%=5.6g,故化肥中氮元素的质量分数为
×100%=5.6g,故化肥中氮元素的质量分数为 ×100%=20.4%>20%,所以为合格化肥.故答案为:20.4%;合格.
×100%=20.4%>20%,所以为合格化肥.故答案为:20.4%;合格.分析:(1)运用质量守恒定律解答;
(2)运用质量守恒定律和根据化学式的计算解答.
点评:本题是综合性计算题,考查质量守恒定律的计算、侧重计算能力的考查,平时学习时一定注意多做多总结规律,寻找解题思路.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
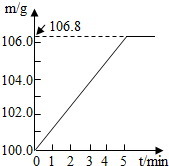 某同学为了检验家里购买的硫酸铵化肥是否合格,称取了27.5g化肥样品与足量浓烧碱溶液一起加热,产生的氨气用足量的100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如右图所示.已知合格硫酸铵化肥中含氮量不低.20%.所涉及的反应为(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑;2NH3+H2SO4=(NH4)2SO4.试计算:
某同学为了检验家里购买的硫酸铵化肥是否合格,称取了27.5g化肥样品与足量浓烧碱溶液一起加热,产生的氨气用足量的100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如右图所示.已知合格硫酸铵化肥中含氮量不低.20%.所涉及的反应为(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑;2NH3+H2SO4=(NH4)2SO4.试计算: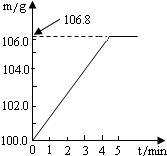
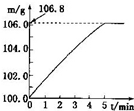 (2011?和平区二模)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氮气用100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如图所示,所涉及的反应为:(NH4)SO4+2NaOH=Na2SO4+2NH3+2H2O↑;2NH3+H2SO4=(NH4)SO4.请计算:(1)完全反应后产生氨气
(2011?和平区二模)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氮气用100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如图所示,所涉及的反应为:(NH4)SO4+2NaOH=Na2SO4+2NH3+2H2O↑;2NH3+H2SO4=(NH4)SO4.请计算:(1)完全反应后产生氨气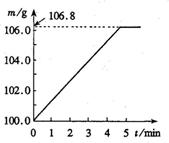 某同学为了检验家里购买的硫酸铵化肥是否合格,称取了27.5g化肥样品与足量浓烧碱溶液一起加热,产生的氨气用足量的100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如右图所示.已知合格硫酸铵化肥中含氮量不低于20%.所涉及的反应为(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑;2NH3+H2SO4=(NH4)2SO4.试计算:
某同学为了检验家里购买的硫酸铵化肥是否合格,称取了27.5g化肥样品与足量浓烧碱溶液一起加热,产生的氨气用足量的100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如右图所示.已知合格硫酸铵化肥中含氮量不低于20%.所涉及的反应为(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑;2NH3+H2SO4=(NH4)2SO4.试计算: