题目内容
【题目】回答下列与基本实验有关的问题。
(实验一)用氯化钠固体和水配制一定质量分数的氯化钠溶液。
实验步骤为:①计算 ②称量 ③量取 ④溶解 ⑤装瓶贴标签
(1)步骤②中,如称量时只在天平左盘放了纸,则所得溶液的溶质质量分数会______(填“偏大”“偏小”“不变”)。
(2)步骤③中,需要用到的仪器有_____________。
(3)步骤④中,玻璃棒的作用是____________。
(实验二)实验室制取气体
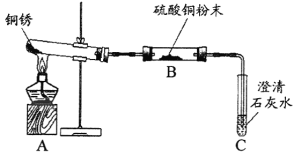
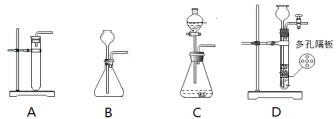
(4)实验室用如图所示的装置制取某种气体。下列说法中,一定正确的是________(填序号)。

A.该气体难溶于水 B.该反应需要催化剂
C.该气体密度比空气大 D.反应物都是固体
(5)晓辉同学打算在实验室用锌粒和稀硫酸制取氢气,但他发现锌粒用完了,只找到了镁条。小跃同学提出只要选用合适的发生装置,用镁条代替也能顺利完成。下列发生装置中,应选用的是_______(填序号)。
【答案】偏小 量筒、胶头滴管 搅拌,加快溶解的速率 D C
【解析】
(1)步骤②中,如称量时只在天平左盘放了纸,根据“左物右码”的原则可知,称量氯化钠的质量偏少,则所得溶液的溶质质量分数会偏小;
(2)步骤③中要量取一定体积的液体,需要用到的仪器有:量筒、胶头滴管;
(3)步骤④溶解中玻璃棒的作用是:搅拌,加快溶解的速率;
(4)A、该装置不能判断气体的溶解性,故A错误;
B、该装置不能判断该反应需要催化剂,故B错误
C、该装置利用向下排空气收集气体,说明该气体密度比空气小,故C错误;
D、该装置能判断反应物都是固体,故D正确;
(5)由于镁与稀硫酸反应的速率较快,若用镁和稀硫酸制取氢气,应选用装置C,通过分液漏斗控制加入硫酸的量来控制反应的速率。

 习题精选系列答案
习题精选系列答案【题目】化学兴趣小组打算测定某石灰石样品中的碳酸钙的质量分数(假设杂质分布均匀,杂质不溶于水也不与稀盐酸反应)。他们向大烧杯中先加入47.2g某浓度的稀盐酸,然后将10.0g石灰石样品粉末平均分4次加入,累计产生气体的质量如下:
加入石灰石样品的次数 | 1次 | 2次 | 3次 | 4次 |
累计产生气体的质量 | 0.88g | 1.76g | mg | 2.2g |
请计算:
(1)上表中m=________。
(2)该石灰石样品中碳酸钙的质量分数为__________ 。
(3)计算第四次加入石灰石样品后所得溶液的溶质质量分数____________