题目内容
 为粗略测量空气中O2与N2的体积比,某学生设计了如右图所示的实验装置进行实验.实验时,先关闭弹簧夹a,将螺旋状的铜丝在酒精灯的灼烧后迅速插入大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞.由于白磷的着火点比红磷低得多,因此反应很容易发生,可观察到大试管中产生大量的白烟.试回答以下问题:
为粗略测量空气中O2与N2的体积比,某学生设计了如右图所示的实验装置进行实验.实验时,先关闭弹簧夹a,将螺旋状的铜丝在酒精灯的灼烧后迅速插入大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞.由于白磷的着火点比红磷低得多,因此反应很容易发生,可观察到大试管中产生大量的白烟.试回答以下问题:
(1)试配平下列化学方程式:______P+______ O2--______P2O5.
(2)待试管冷却后打开弹簧夹,此时可观察到的现象为______,据此可证实空气中O2与N2的体积比大约为______.
(3)如果装置气密性不好,则测出的O2与N2的体积比将______(填“偏大”、“偏小”、或“不变”).
解:(1)根据观察法来配平方程式,为4P+5O2 2P2O5;
2P2O5;
(2)由于燃烧消耗氧气,使瓶内气压减小而吸入水,且氧气中空气体积的五分之一,所以水会进入试管的五分之一,剩余的气体主要是氮气,约占空气体积的五分之四,空气中O2与N2的体积比大约为1:4;
(3)装置漏气会使水进入的偏小,故实际测出的氧气的量偏小,导致结果偏小.
故答案为:(1)4、5、2;
(2)水进入试管中约五分之一、1:4;
(3)偏小.
分析:(1)观察法配平方程式;
(2)由于燃烧消耗氧气使瓶内气压减小而吸入水;
(3)装置漏气会使水进入的偏小.
点评:此题是空气成分检验考查题,解题的关键是对整个实验的原理操作及注意事项的掌握,属基础性实验知识考查题.
 2P2O5;
2P2O5;(2)由于燃烧消耗氧气,使瓶内气压减小而吸入水,且氧气中空气体积的五分之一,所以水会进入试管的五分之一,剩余的气体主要是氮气,约占空气体积的五分之四,空气中O2与N2的体积比大约为1:4;
(3)装置漏气会使水进入的偏小,故实际测出的氧气的量偏小,导致结果偏小.
故答案为:(1)4、5、2;
(2)水进入试管中约五分之一、1:4;
(3)偏小.
分析:(1)观察法配平方程式;
(2)由于燃烧消耗氧气使瓶内气压减小而吸入水;
(3)装置漏气会使水进入的偏小.
点评:此题是空气成分检验考查题,解题的关键是对整个实验的原理操作及注意事项的掌握,属基础性实验知识考查题.

练习册系列答案
相关题目
 为粗略测量空气中O2与N2的体积比,某学生设计了如 图 所示的实验装置进行实验.实验时,先关闭弹簧夹,将螺旋状的铜 丝在酒精灯上灼烧后迅速插入大试管,接触试管底部的过量的白磷(白磷在空气中燃烧的温度为40℃),然后立即塞紧橡皮塞,可观察到大试管中产生大量的白烟.试回答以下问题:
为粗略测量空气中O2与N2的体积比,某学生设计了如 图 所示的实验装置进行实验.实验时,先关闭弹簧夹,将螺旋状的铜 丝在酒精灯上灼烧后迅速插入大试管,接触试管底部的过量的白磷(白磷在空气中燃烧的温度为40℃),然后立即塞紧橡皮塞,可观察到大试管中产生大量的白烟.试回答以下问题: 为粗略测量空气中O2与N2的体积比,某学生设计了如右图所示的实验装置进行实验.实验时,先关闭弹簧夹a,将螺旋状的铜丝在酒精灯的灼烧后迅速插入大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞.由于白磷的着火点比红磷低得多,因此反应很容易发生,可观察到大试管中产生大量的白烟.试回答以下问题:
为粗略测量空气中O2与N2的体积比,某学生设计了如右图所示的实验装置进行实验.实验时,先关闭弹簧夹a,将螺旋状的铜丝在酒精灯的灼烧后迅速插入大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞.由于白磷的着火点比红磷低得多,因此反应很容易发生,可观察到大试管中产生大量的白烟.试回答以下问题: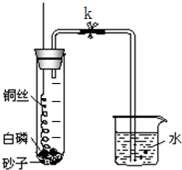 为粗略测量空气中O2与N2的体积比,某学生设计了如图所示的实验装置进行实验.实验时,先关闭弹簧夹k,将螺旋状的铜丝在酒精灯火焰上灼烧后迅速插入大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞.由于白磷的着火点(燃烧所需的最低温度)比红磷低得多,因此反应很容易发生,可观察到大试管中产生大量的白烟.
为粗略测量空气中O2与N2的体积比,某学生设计了如图所示的实验装置进行实验.实验时,先关闭弹簧夹k,将螺旋状的铜丝在酒精灯火焰上灼烧后迅速插入大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞.由于白磷的着火点(燃烧所需的最低温度)比红磷低得多,因此反应很容易发生,可观察到大试管中产生大量的白烟. 为粗略测量空气中O2与N2的体积比,某学生设计了如图所示的实验装置进行实验.实验时,先关闭弹簧夹k,将螺旋状的铜丝在酒精灯火焰上灼烧后迅速插入大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞.由于白磷的着火点(燃烧所需的最低温度)比红磷低得多,因此反应很容易发生,可观察到大试管中产生大量的白烟.
为粗略测量空气中O2与N2的体积比,某学生设计了如图所示的实验装置进行实验.实验时,先关闭弹簧夹k,将螺旋状的铜丝在酒精灯火焰上灼烧后迅速插入大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞.由于白磷的着火点(燃烧所需的最低温度)比红磷低得多,因此反应很容易发生,可观察到大试管中产生大量的白烟.