题目内容
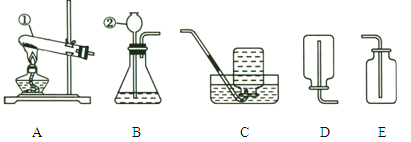
【题目】下图所示为实验室中常见的气体制备和收集装置。
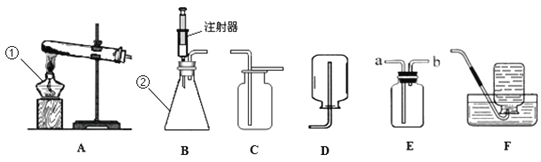
(1)写出仪器的名称①______;②_______。
(2)实验室用高锰酸钾制取氧气,应选用发生装置______(填字母),反应的化学方程式为______。若用装置C收集氧气,验满的方法是______。
(3)实验室用过氧化氢溶液和二氧化锰制取氧气,反应的化学方程式为_______。若选用B做发生装置,你认为选用B的优点是_______。
(4)欲使用装置E用排空气法收集氧气,则气体应从_____(填“a”或“b”)端通入。
(5)氨气极易溶于水,常温常压下1体积水可溶解700体积的氨气。氨气的密度比空气小。实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取,则实验室制取氨气应选择的发生装置是______,收集装置为____(填序号)。
【答案】酒精灯 锥形瓶 A 2KMnO4![]() K2MnO4+MnO2+O2↑ 将带火星的木条放在集气瓶口,若木条复燃,说明氧气收集满 2H2O2
K2MnO4+MnO2+O2↑ 将带火星的木条放在集气瓶口,若木条复燃,说明氧气收集满 2H2O2![]() 2H2O+O2↑ 可以控制反应的速率 a A D或E
2H2O+O2↑ 可以控制反应的速率 a A D或E
【解析】
(1)据图可知仪器①是酒精灯,②是锥形瓶;
(2)实验室用高锰酸钾制取氧气,是固体加热制取气体,应选用发生装置 A,是高锰酸钾加热生成锰酸钾、二氧化锰和氧气,对应的化学方程式为 2KMnO4![]() K2MnO4+MnO2+O2↑;若用装置C收集氧气,验满的方法是 将带火星的木条放在集气瓶口,若木条复燃,说明氧气收集满;
K2MnO4+MnO2+O2↑;若用装置C收集氧气,验满的方法是 将带火星的木条放在集气瓶口,若木条复燃,说明氧气收集满;
(3)实验室用过氧化氢溶液和二氧化锰制取氧气,是过氧化氢在二氧化锰的催化下生成水和氧气,对应的化学方程式为 2H2O2![]() 2H2O+O2↑;若选用B做发生装置,由于可以通过注射器控制滴加液体速度,所以B的优点是可以控制反应的速率;
2H2O+O2↑;若选用B做发生装置,由于可以通过注射器控制滴加液体速度,所以B的优点是可以控制反应的速率;
(4)欲使用装置E用排空气法收集氧气,由于氧气的密度大于空气,所以气体应从 a端通入;
(5)由于“氨气极易溶于水,常温常压下1体积水可溶解700体积的氨气。氨气的密度比空气小”,所以需要用向下排空气法,需要用D或者E;而实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取,则发生装置为A,则实验室制取氨气应选择的装置组合是 AD或AE。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】某研究小组用如图所示装置,探究能否用镁条代替红磷测定空气中氧气含量。
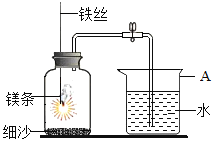
(提出猜想)
猜想1:可以代替,因为镁条与氧气反应后不会产生气体
猜想2:不能代替,因为镁条可能会与空气中的其他成分发生反应
(进行实验)
步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装好装置后,打开止水夹,手捂集气瓶,一段时间后,松开手 | 烧杯中导管口有气泡冒出,松手后,烧杯中导管末端有一段液柱 |
Ⅱ | 关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子 | 镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物还夹杂着极少量淡黄色的固体 |
Ⅲ | 冷却至室温,打开止水夹 | 烧杯中水从导管进入集气瓶中,体积约为集气瓶体积的 |
(解释与结论)
(1)步骤Ⅰ的实验目的是_____。
(2)步骤Ⅱ中,关闭止水夹的目的是_____。
(3)根据实验现象中的_____(写一个即可)可以推测猜想2成立。
①(继续探究)经查阅资料得知氮化镁(Mg3N2)为淡黄色的固体,于是小晴猜想镁条还可能会与空气中的_____发生反应;
②(设计实验)她设计实验方案证明自己的猜想_____;
③(实验结论)镁条与氮气反应的化学方程式为:_____;
④(反思与评价)通过上述探究活动,你对燃烧有什么新的认识?_____。