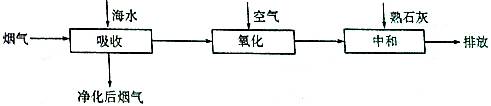
题目内容
将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如下图所示,下列说法中正确的是
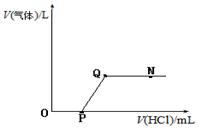

| A.N 点时,所得溶液的pH=7 |
| B.Q点时,所得溶液中的溶质只含有BaCl2 |
| C.O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O |
| D.P至Q段发生反应的化学方程式为Ba(OH)2+2HCl=BaCl2+2H2O |
C
试题分析:将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,得到碳酸钡和氢氧化钠的混合物,滴加盐酸发生反应O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O;P至Q段发生碳酸钡和盐酸的反应;Q点时氢氧化钠和碳酸钡反应完全,溶液中的溶质为氯化钡和氯化钠;N点是盐酸过量的点,故溶液显酸性,pH<7;所以答案选择C

练习册系列答案
相关题目